 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 87 篇 doi: 10.5376/mpb.cn.2011.09.0087
收稿日期: 2011年06月07日 接受日期: 2011年06月27日 发表日期: 2011年06月30日
王惠哲等, 2011, 黄瓜抗黑斑病相关AFLP标记筛选及SCAR转化, 分子植物育种 Vol.9 No.87 (doi: 10.5376/mpb.cn.2011.09.0087)
为筛选与黄瓜抗黑斑病相关基因连锁的分子标记,探讨黄瓜抗病材料鉴定和选择的分子方法。以黄瓜感黑斑病母本L63和抗黑斑病父本L9及其F2代分离群体为试材,人工接种抗病性鉴定结果表明,一对隐性基因控制黄瓜黑斑病的抗病性,感病性为不完全显性。通过BSA法和AFLP分子标记建立了黄瓜对黑斑病的抗病组和感病组,应用1 024对引物组合EcoRⅠ-NN/MseⅠ-NNN对抗、感组进行筛选,筛选到了1个与黄瓜抗、感黑斑病相关基因连锁的共显性标记E-AT/M-TCT。测序结果表明,片段长度分别为246 bp和251 bp,为发生插入/缺失突变的同源序列;经组外其它F2单株分析,在抗病个体中扩增出了246 bp的特异片段,而感病个体中扩增出了251 bp的特异片段,中间类型单株则同时扩增出该两个特异片段,该特异标记与黄瓜黑斑病抗性相关基因紧密连锁,遗传距离为4.96 cM;根据测序结果,将其成功转化为1对SCAR标记。
黄瓜黑斑病[Alternaria cucumerina (Ell et Ev.) Elliott.]是由瓜链格孢菌引起的真菌性病害(吕佩珂等, 1992)。该病近几年又卷土重来,在各地普遍发生,成为黄瓜生产上的重要病害。该病主要危害叶片,一般先从黄瓜的中、下部叶片开始发生,而后逐渐向上蔓延,大约在4月中旬至5月上、中旬发生,发病率高达60%以上,减产10%~20% (梁金兰, 1992)。而生产上所采用的很多材料、品种多不抗黑斑病,因此抗黑斑病又成为培育黄瓜新品种的一个重要指标。常规的抗病材料筛选及抗病品种选育方法存在费时、费力、效率低、病菌扩散等问题,分子标记的应用为抗病材料的筛选提供了一种全新的方法,对加快抗病品种选育速度,大大提高育种效率具有重要应用价值。
AFLP标记技术现已普遍地用于图谱的构建(易克, 2004; 张海英, 2006)、性状连锁标记的筛选(廖毅, 2009; 顾兴芳等, 2006; 张桂华等, 2004; 王惠哲等, 2007, 2009; Wang et al., 2010)、亲缘关系的分析(孟淑春等, 2008; 张天明等, 2006)等工作。前人经研究已先后获得与黄瓜白粉病(张桂华等, 2004)、霜霉病(张素勤等, 2010)、炭疽病(王惠哲等, 2007)、黑星病(王惠哲等, 2009)和褐斑病(Wang et al., 2010)等抗病性连锁的分子标记,这些成果对品种的性状改良已起到重要的促进作用。与黄瓜抗黑斑病的相关分子标记研究尚未见报道,作者利用AFLP技术结合BSA法,筛选与黄瓜抗黑斑病相关的分子标记,同时将其转化为简单实用的SCAR标记,可加快黄瓜的抗病育种进程。
1结果与分析
1.1抗病性鉴定结果
采用喷雾法对242个F2单株进行苗期人工接种鉴定,6~15 d后调查发病情况。在242个F2单株中,抗病单株58个,感病单株60个,中间类型单株124个,适合性测验表明分离比例符合1:2:1 (表1);在88个BC1a回交群体中,抗病个体43株,中间类型个体45株,在85个BC1b回交群体中,中间类型个体42株,感病个体43株,均符合1:1的分离比例,说明在本材料的遗传背景下,表明黄瓜对黑斑病菌株086的抗性由一对隐性基因控制,感病相对于抗病为不完全显性。
表1 黄瓜黑斑病抗性接种鉴定结果 Table 1 Resistance identification results of cucumber alternaria leaf spot |
1.2 AFLP引物的筛选及验证
以感黑斑病母本L63和抗黑斑病父本L9为试材,进行了初步的引物筛选,1 024对AFLP引物中300对在双亲间表现多态性,多态性引物比率为29.3% (图1)。用亲本筛选到的300对引物组合对抗病组和感病组的F2单株进行PCR扩增,初步获得了一个与黄瓜黑斑病抗性相关基因连锁的共显性AFLP标记E-AT/M-TCT。该标记在抗病组中扩增出了246 bp的特异条带,在感病组单株扩增出了251 bp的特异条带。经对组外其余F2单株检测,结果显示,58个抗病单株中有4株扩增出了251 bp的感病带,60个感病单株中有8株扩增出了246 bp的抗病带,中间类型单株则同时扩增出该两个特异片段。由此计算扩增带型与黑斑病抗性的实际表现型的符合度,表明该标记与黄瓜黑斑病抗性相关基因紧密连锁,遗传距离为4.96 cM。
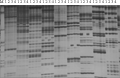 图1 抗病、感病的AFLP分析 Figure 1 AFLP analysis between the resistant and susceptible plant |
1.3 AFLP标记的SCAR转化
采用煮沸法将两个特异片段从银染胶上回收,并测序。测序结果显示,抗病带大小为246 bp,感病带为251 bp,二者的差异在于5个碱基“ATGGG”的插入和缺失(图2)。并将该标记成功转化为1对更为稳定的SCAR标记,上游引物:5'-GCCGGCGACTAATAATCA-3';下游引物:5'-CCTGAGTAATCTATAAAGCGTCG-3' (已申报国家发明专利, 申请号为: 201010197951.4)。
图2 与黄瓜抗黑斑病相关基因连锁的AFLP标记片段的碱基序列 Figure 2 Sequence of the AFLP marker fragments associated to the resistance locus of cucumber alternaria leaf spot |
利用所设计的SCAR引物对部分抗、感病单株进行扩增,扩增产物经5%变性聚丙烯酰胺凝胶电泳检测,可以看出原来的多态性仍然存在(图3)。在抗病单株、感病单株中分别扩增出200 bp、205 bp长的片段,表明该标记仍然为共显性标记,可以用于黄瓜黑斑病的分子鉴定。该共显性的SCAR标记是黄瓜黑斑病分子标记研究中的第一个,因此将该标记命名为SA861。表明已成功地将该AFLP标记转化为SCAR标记。图4为引物861在部分F2单株中的验证。
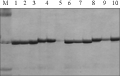 图3 SCAR标记861的扩增产物 Figure 3 SCAR amplification by primer 861 |
图4 SCAR标记861在部分F2单株中的扩增 Figure 4 Amplification of SCAR marker 861 in some of F2 plants |
2讨论
本研究利用AFLP技术和BSA法明确了黄瓜对黑斑病的抗性由一个隐性基因控制,可为亲本选配和杂交组合配制提供可靠依据;并获得了与黄瓜黑斑病抗性相关基因紧密连锁的分子标记E-AT/M-TCT,遗传距离为4.96 cM,表明该标记可用于黄瓜抗黑斑病辅助育种;根据序列特点将该标记成功转化为1对SCAR标记,SCAR引物扩增产物原来的多态性仍然存在,但 ATGGG五个碱基的差别仍需借助PAGE (变性聚丙烯酰胺凝胶电泳)进行分离,虽然不如琼脂糖凝胶电泳简单,但PAGE可同时将抗病株、感病株和杂合株检测出来,利于大量材料的抗性鉴定,大大降低了AFLP技术相关操作的繁琐性。
本研究获得的分子标记,为黄瓜抗黑斑病育种材料的筛选和抗病品种选育提供了一种新的方法,可在早代对表现优良的基因型进行鉴定,而且稳定可靠,不受环境因素及季节的限制,提高鉴定的准确性;可以实现黄瓜材料黑斑病抗性的快速、准确鉴定,加快抗病品种选育速度,大大提高育种效率。结合白粉病、霜霉病、炭疽病、褐斑病和黑星病的相关标记可以快速实现黄瓜苗期多抗材料的筛选以及多抗基因的聚合,快速培育出市场前景良好的优质、多抗的黄瓜新品种。兼抗多种病害黄瓜良种的应用,可以降低农药用量,减轻环境污染,因此,本项研究具有较大的实践与理论意义,并会带来可观的社会、经济效益。
3材料与方法
3.1材料
供试材料为黄瓜高代自交系L63 (高感黑斑病)和L9 (高抗黑斑病)及其自交群体(F2) 242个单株。黄瓜黑斑病菌086为田间自然发病叶分离、鉴定并保存。在上海生工生物工程公司合成AFLP引物,Taq DNA酶、dNTP等试剂购自大连宝生物公司。
于2008~2011年在天津科润黄瓜研究所内完成试验。
3.2方法
3.2.1抗病性鉴定
将抗、感病亲本、及F1、F2、BC1a、BC1b六世代群体播种于装有灭菌蛭石的育苗钵中,放置于光照培养箱中,正常管理。采用第一真叶喷雾接种法(孢子浓度1~2×l07孢子/mL)进行黑斑病菌接种鉴定。采用如下分级标准(0级: 无病症; 1级: 接种叶出现少数病斑; 2级: 叶柄有轻微症状, 病斑占叶面积的1/3以下; 3级: 叶柄变色, 病斑占叶面积的1/3-1/2; 4级: 叶柄干枯, 病斑占叶面积的1/2-2/3; 5级: 叶柄干枯并下垂, 病斑占叶面积的2/3以上)
3.2.2抗病、感病组构建及AFLP分析
采用改良的CTAB法分别提取各单株基因组DNA,经紫外分光光度计检测合格后稀释至50 ng/μL。根据BSA法的原理,在抗病、感病群体中选取症状明显的高度抗病、感病单株各5株组成抗病组和感病组。
AFLP分析参照Vos (Vos et al., 1995)的方法。PCR产物经5% PAGE (变性聚丙烯酰胺凝胶电泳)分离,然后银染检测。
3.2.3 AFLP标记筛选、验证
先在抗病、感病亲本间进行引物筛选,利用在双亲间表现多态性的引物对抗病组和感病组单株进行扩增,在抗病组和感病组间表现多态性的引物组合可初步入选。筛选到的标记与抗性基因的连锁关系经组外其余F2单株验证可进一步得到确认。用筛选出的标记对生产上已知黑斑病抗性的品系分别进行分析,计算扩增带型与黑斑病抗性的实际表现型的符合度。
3.2.4特异片段的回收、测序及SCAR转化
采用煮沸法回收特异片段,扩增产物送至北京三博远志生物公司测序。
根据DNA序列特点,遵循引物设计的一般原则进行特异性SCAR引物的设计(上海生工公司合成),SCAR扩增体系、程序及检测参照王惠哲等(王惠哲等, 2008)的方法。
作者贡献
王惠哲、李淑菊、杨瑞环和管炜是本研究的实验设计和实验研究的执行人;王惠哲、李淑菊完成数据分析,论文初稿的写作;杨瑞环和管炜参与实验设计,结果分析。李淑菊是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由天津市自然科学基金课题(09JCZDJC18900和11JCYBJC09000)资助。
参考文献
Chandler, L.D., and Thomas, C.E., 1991, Effect of leaf miner feeding activity on the incidence of Alternaria blight lesions on muskmelon leaves, Plant Dis., 75: 938-940 http://dx.doi.org/10.1094/PD-75-0938
Gu X.F., Zhang S.Q., and Zhang S.P., 2006, The AFLP Markers Linked with the Bitter Fruit Gene (Bt) in Cucumber, Yuanyi Xuebao (Acta Horticulturae Sinica), 33(1): 140-142 (顾兴芳, 张素勤, 张圣平, 2006, 黄瓜果实苦味Bt基因的AFLP分子标记, 园艺学报, 33(1): 140-142)
Latin, R.X., 1992, Modeling the relationship between Alternaria leaf blight and yield loss in muskmelon, Plant Dis., 76: 1013-1017 http://dx.doi.org/10.1094/PD-76-1013
Li S.J., Wang H.Z., Huo Z.R., and Guan W., 2008, Development of SCAR Marker Linked to Cucumber Anthracnose Resistance-related Gene from an AFLP Marker, Yuanyi Xuebao (Acta Horticulturae Sinica), 35(1): 123-126 (李淑菊, 王惠哲, 霍振荣, 管炜, 2008, 黄瓜抗炭疽病相关基因AFLP标记的SCAR转换, 园艺学报, 35(1): 123-126)
Liang J. L., 1992, Occurrence and control of alternaria leaf spot disease on cucumber, Henan Nongye Kexue (Henan Agricultural Sciences), 1: 30-31 (梁金兰, 1992, 黄瓜黑斑病的发生与防治, 河南农业科学, 1: 30-31)
Liao Y., Sun B.J., Sun G.W., Liu H.C., Li Z.L., Li Z.X., Wang G.P., and Chen R.Y., 2009, AFLP and SCAR Markers Associated with Peel Color in Eggplant, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 42(11): 3996-4003 (廖毅, 孙保娟, 孙光闻, 刘厚诚, 李植良, 黎振兴, 汪国平, 陈日远, 2009, 与茄子果皮颜色相关联的AFLP及SCAR标记, 中国农业科学, 42(11): 3996-4003)
Lv P.K., Li M.Y., Wu J.W., Yi Q., Zhang B.L., Jiang K.Y., Wen Q., Li M.Z., and Wang R.C., eds., 1992, Atlas of Insect Pests and Diseases of Vegetable Crops in China, Agricultural Publishing House, Beijing, China, pp.18-19 (吕佩珂, 李明远, 吴钜文, 易齐, 张宝椂, 姜克英, 文奇, 李明周, 王润初, 著, 中国蔬菜病虫原色图谱, 农业出版社, 中国, 北京, pp.18-19)
Meng S.C., Liu Y.M., Zheng X.Y., and Wang Y.J., 2008, Studies on Genetic Relationships among Chinese Cabbage, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 24(7): 307-313 (孟淑春, 刘玉梅, 郑晓鹰, 王永健, 2008, 大白菜亲缘关系研究, 中国农学通报, 24(7): 307-313)
Tanksley S.D., Ganal M.W., Prince J.P., de-Vicente M.C., Bonierbale M.W., Broun P., Fulton T.M., Giovannoni J.J., Grandillo S., Martin G. B., Messeguer R., Miller J.C., Miller L., Paterson A.H., Pineda O., Roder M.S., Wing R.A., Wu W., and Young N.D., 1992, Hish density molecular linkage maps of the tomato and potato genomes, Genet, 132: 1141-1160
Thomas C.E., McCreight J.D., and Jourdain E.L., 1990, Inheritance of resistance to Alternaria cucumerina in cucumis melo line MR-1, Plant Dis., 74: 868-870 http://dx.doi.org/10.1094/PD-74-0868
Vos P., Hongers R., Bleeker M., Reijans M., Van de Lee T., Hornes M., 1995, AFLP: a new technique for DNA fingerprinting, Nucleic Acids Res., 23(21): 4407-4414 http://dx.doi.org/10.1093/nar/23.21.4407
Wang H.Z., Li S.J., and Guan W., 2009, SSR Marker Linked to Cucumber Scab Resistance-Related Gene, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(3): 550-554 (王惠哲, 李淑菊, 管炜, 2009, 与黄瓜抗黑星病相关基因紧密连锁的SSR标记, 分子植物育种, 7(3): 550-554)
Wang H.Z., Li S.J., Liu X.F., Li P, Huo Z.R., and Guan W., 2007, AFLP Markers of Cucumber Anthracnose Resistance- related Gene, Yuanyi Xuebao (Acta Horticulturae Sinica.), 34(1): 213-216 (王惠哲, 李淑菊, 刘秀峰, 李平, 霍振荣, 管炜, 2007, 与黄瓜抗炭疽病相关基因连锁的AFLP标记的筛选, 园艺学报, 34(1): 213-216)
Wang H.Z., Li S.J., Yang R.H., and Guan W., 2010, EST-SSR Marker Linked to Cucumber Target Leaf Spot Resistance- related Gene, Acta Horticulturae, 871: 49-55
Yacoub B., 2003, Alternaria leaf spot disease on cucumber: Susceptibility and control using leaf disk assay, An-Najah Univ. J. Res. (N. Sc.), 17(2): 269-279
Yi K., Xu Y., Lu X.Y., Xiao L.T., Xu X.L., Gong G.Y., and Zhang H.Y., 2004, Construction of AFLP Molecular Genetic Map for RIL Population of WatermelonYuanyi Xuebao (Acta Horticulturae Sinica), 31(1): 53-58 (易克, 许勇, 卢向阳, 肖浪涛, 徐向利, 宫国义, 张海英, 2004, 西瓜重组自交系群体的AFLP分子图谱构建, 园艺学报, 31(1): 53-58)
Zhang G.H., Du S.L., Wang M., Ma D.H., 2004, AFLP Markers of Cucumber Powdery Mildew Resistance-related Gene, Yuanyi Xuebao (Acta Horticulturae Sinica), 31(2): 189- 192 (张桂华, 杜胜利, 王鸣, 马德华, 2004, 与黄瓜抗白粉病相关基因连锁的AFLP标记的获得, 园艺学报, 31(2): 189-192)
Zhang H.Y., 2006, Identification of Molecular-markers Linked to Important Resistant genes and Construction of Genetic Map in Cucumber, Dissertation for Ph.D., Biotechnology Research Institute CAAS, Supervisor: Fang Z.Y., and Wang Y.J., pp.68-86 (张海英, 2006, 黄瓜重要抗病基因的分子标记研究及遗传图谱的构建, 博士学位论文, 中国农业科学院研究生院, 导师: 方智远, 王永健, pp.68-86)
Zhang S.Q., Gu X.F., Zhang S.P., Wang X.W., and Zou Z.R., 2010, Tagging a Downy Mi ldew Resistance Related Gene in Cucumber Using AFLP Marker, Xibei Zhiwu Xuebao (Acta Bot. Boreal.-Occident. Sin.), 30(7): 1320-1324 (张素勤, 顾兴芳, 张圣平, 王晓武, 邹志荣, 2010, 黄瓜霜霉病抗性相关基因的AFLP标记, 西北植物学报, 30(7): 1320-1324)
Zhang T.M., Qu D.Y., Wang C.L., Wang Y.J., and Liu Y.S., 2006, Relationships Analysis of Cucurbita by AFLP, Zhongguo Shucai (China Vegetables), 1: 11-14 (张天明, 屈冬玉, 王长林, 王迎杰, 刘宜生, 2006, 南瓜属4个栽培种亲缘关系的AFLP分析, 中国蔬菜, 1: 11-14)