2四川农业大学林学院, 成都, 611130
3武胜县街子工业园区管理委员会, 广元, 638404
4崇明县林业站, 上海, 200232
5崇明县公益林管理办公室, 上海, 202150
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 105 篇 doi: 10.5376/mpb.cn.2011.09.0105
收稿日期: 2011年08月29日 接受日期: 2011年09月26日 发表日期: 2011年09月29日
引用格式(中文):
曾艳等, 2011, 4种水仙种质资源的ISSR和AFLP遗传多样性分析, 分子植物育种(online) Vol.9 No.105 pp.1759-1765 (doi: 10.5376/mpb.cn.2011.09.0105)
引用格式(英文):
Zeng et al., 2011, 4 Kinds of Narcissus Germplasm Resources of ISSR and AFLP Analysis of Genetic Diversity, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.9 No.105 pp. 1759-1765 (doi: 10.5376/mpb.cn.2011.09.0105)
本研究对水仙属(Narcissus)植物的简单序列重复(ISSR-PCR)和扩增片段长度多态性(AFLP)反应体系进行了优化,确立了水仙属植物的ISSR-PCR和AFLP的最佳反应条件。利用AFLP和ISSR分子标记手段对崇明水仙、漳州水仙、状元水仙、洋水仙种质资源遗传多样性进行了检测。结果发现:AFLP标记多态性高于ISSR标记,但并没有发现有效揭示中国水仙种群间遗传变异的特异性标记;中国水仙与洋水仙(GS值分别为0.880, 0.5128)亲缘关系较远。本文还推测导致崇明水仙与漳州水仙在形态上差异的原因是表型遗传,由地理差异造成。状元水仙是漳州水仙或崇明水仙的变种尚未得到验证。
水仙属(Narcissus Linn.)植物属石蒜科(Amaryllidaceae) 多年生草本植物,普遍为人知的包括漳州水仙(Zhangzhou Narcissus)、崇明水仙(Chongming Narcissus)、普陀水仙(Putuo Narcissus)、平潭水仙(Pingtan Narcissus)、舟山水仙(Zhoushan Narcissus)等,统称为中国水仙(Narcissus tazetta L. var. chinensis Roem.)。崇明水仙在崇明县已有400多年的栽培史,具有花香幽雅、花期长等特点。早在二十世纪三十年代已销往上海、江苏等地,是上海最具特色的传统品牌之一。关于漳州水仙和崇明水仙分类一直存在系同一种源的说法。相传古时,一艘满载水仙球茎的漳州帆船在长江口翻沉,几年后,崇明人发现江滩上长满了好看的花,就连根挖起移种到花圃。经过几代人精心培育,育成了崇明水仙。洋水仙和中国水仙同为石蒜科水仙属的植物,是水仙属的不同物种,都是深受人们欢迎的花卉。正如她的名字“洋水仙”,是漂洋过海从外国引进的品种,本文提到的洋水仙主要是胡德山(Narcissus ‘Paricutin’ ‘Mount Hood’),阳光光盘(Narcissus ‘Sun Disc’),帕里库廷火山(Narcissus ‘Paricutin’)和塔希提(Narcissus ‘Tahiti’)。
目前,有关水仙的研究多集中于组织培养以及染色研究等方向,崇明水仙与漳州水仙的分类系统一直没有得到很好的定位,多数定位为中国水仙的两大不同栽培类型,品种也较为混乱。于是,本实验旨在通过ISSR-PCR标记(王建波, 2002)及AFLP分子标记指纹图谱分析(蒋细旺和张启翔, 2006; 江梅等, 2006),为确立4种水仙种源资源的起源提供分子依据。
1结果与分析
1.1 ISSR-PCR优化反应体系的建立
以崇明重瓣水仙DNA为模板,从100个引物中扩增出32个有条带的引物。再利用崇明单瓣水仙、漳州单瓣水仙、漳州重瓣水仙、状元水仙、洋水仙对筛选出来的32个引物进行复选,最后得到23对扩增出清晰条带的引物(表1)。
.png)
表1 23个引物编号, 碱基序列和扩增结果
Table 1 Name of 23 primers, sequence and their amplication results
综合单因素优化体系中各反应参数的浓度梯度试验,确立的崇明水仙ISSR-PCR反应的适宜条件为:20 μL反应体系中各参数的含量为模板DNA 50 ng,Tag DNA聚合酶1 U,引物浓度0.5 μmol/L,dNTPs浓度0.25 mmol/L,10×PCR Buffer 3.5 μL,最佳退火温度为56.8℃。
通过单因素和正交设计对比发现,采用正交设计优化的反应体系效果最好(图1),反应体系更稳定。该体系为:20 μL反应体系中各参数的含量为模板DNA 50 ng,TagDNA聚合酶1 U,引物浓度0.5 μmol/L,dNTPs浓度0.3 mmol/L,10×PCR Buffer 2.5 μL,最佳退火温度为56.8℃。
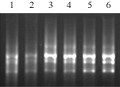
图1 三种反应体系效果比较
Figure 1 Effect comparison of three reaction systems
根据优化后的反应体系对每个水仙种群的DNA模板进行ISSR-PCR扩增,每个引物可扩增出3~11条DNA片段,平均5条。23个引物共扩增出115条带,其中36条具有多态性,多态性比率为31.3% (见表1)。
1.2 AFLP标记分析
试验从64对引物中筛选了多态性高、分辨力强、条带清晰的8对引物,对崇明水仙、漳州水仙、状元水仙以及洋水仙进行了AFLP分析,每对引物组合产生的条带数目不等(表2),共扩增得到328条清晰可统计的条带,其中多态性条带258条,多态性比率共计78.7%;平均每对引物扩增出条带41条,具多态性的条带32.25条,多态性比率变幅在67.5%~88.1%间;其中,引物5-8产生的条带最少,共扩增26条;引物8-3扩增出49条;引物5-1在 445 bp、引物8-1在155 bp、引物8-3在278 bp处对四种洋水仙(胡德山(Narcissus ‘Paricutin’ ‘Mount Hood’), 阳光光盘(Narcissus ‘Sun Disc’), 帕里库廷火山(Narcissus ‘Paricutin’), 塔希提(Narcissus ‘Tahiti’))都扩增出特异性条带,而在漳州水仙、崇明水仙、状元水仙种群均没有扩增出条带(图2)。
![]()
表2 AFLP选择性扩增引物和扩增结果
Table 2 AFLP primer combinations and amplification
![]()
图2 AFLP引物5-1, 8-1, 8-3对21个样品的PCR扩增图
Figure 2 The PCR amplification of 21 samples using primer 5-1, 8-1, 8-3
1.3遗传相似性分析
对23 个ISSR引物产生的扩增片段进行统计计算出供试材料间的遗传相似系数(GS) (表3),分布在0.847 8~0.979 9之间,平均值为0.90。漳州单瓣水仙和漳州重瓣水仙GS值为0.971 3,崇明单瓣水仙和崇明重瓣水仙GS值高达0.979 9,崇明水仙和漳州水仙平均GS值为0.965,分析结果表明漳州水仙和崇明水仙之间的亲缘关系很近,居群间的遗传分化较小;状元水仙和漳州单瓣水仙的 GS值为0.972 1,与漳州重瓣水仙的GS值为0.953 3,平均GS值为0.962 7,达到高度相似;状元水仙和崇明单瓣水仙的GS值为0.956 3,与崇明重瓣水仙的GS值为0.942 1,平均为0.949 2。洋水仙四个品种个体间平均遗传相似系数为0.88,表明洋水仙居群品种间遗传多样性较为丰富;漳州水仙、崇明水仙、状元水仙三者间的平均GS值为 0.965,表明它们之间的亲缘关系较近;它们与洋水仙四个品种间的平均GS值为0.87,表明三种中国水仙与洋水仙的亲缘关系相对较远。

表3 样品间的Nei氏相似性系数矩阵(ISSR)
Table 3 Nei's similarity of coefficient matrix of samples (ISSR)
同样,对8对AFLP引物的扩增片段进行统计,计算出中国水仙与洋水仙的遗传相似系数(表4)。种群间的遗传相似系数(GS)变幅为0.261 3~0.633 5,平均值为0.508。如表3和表4所示,AFLP标记结果与ISSR标记相似,崇明水仙与漳州水仙亲缘较近,漳州水仙、崇明水仙、状元水仙与洋水仙的亲缘关系远:漳州单瓣水仙和重瓣水仙GS值为0.633 5,崇明单瓣水仙和崇明重瓣水仙GS值为0.588 6,崇明水仙和漳州水仙平均GS值为0.615 7;状元水仙与漳州单瓣水仙、漳州重瓣水仙的GS值分别为0.625 2、0.609 5;状元水仙和崇明单瓣水仙的GS值为0.565 0,与崇明重瓣水仙的GS值为0.614 4,这表示状元水仙与漳州水仙、崇明重瓣水仙的亲缘关系相近;洋水仙四个品种个体间平均遗传相似系数为0.512 8;供试3种中国水仙的平均GS值为0.614 1,洋水仙的平均GS值为0.296 5。

表4 样品间的Nei氏相似性系数矩阵(AFLP)
Table 4 Nei's similarity of coefficient matrix of samples (AFLP)
2结论与讨论
本实验利用ISSR分子标记和AFLP指纹图谱对中国水仙的崇明水仙、漳州水仙、状元水仙和洋水仙种群进行标记,分别建立了水仙属植物的ISSR标记和 AFLP优化反应体系,AFLP标记多态性高于ISSR标记。实验筛选出23个ISSR引物,共扩增出115条带,其中36条具有多态性,多态性比率为 31.3%;8对AFLP引物共扩增得到328条清晰可统计的条带,其中多态性条带258条,多态性比率共计78.7%。然而,在两种标记中均没有找到有效的揭示中国水仙种群间遗传变异的特异性标记。利用这两种标记对水仙种群间的遗传差异进行分析,结果一致,ISSR得出的崇明水仙与漳州水仙遗传距离 0.003 5,AFLP的结果是0.384 3,表明崇明水仙与漳州水仙亲缘关系很近,在一定程度上印证了漳州水仙和崇明水仙同一起源的说法;两种标记结果显示中国水仙与洋水仙(GS值分别为 0.880, 0.512 8)亲缘关系较远。ISSR标记与AFLP分析结果显示中国水仙的各种群间差异很小。一方面,中国水仙为同源三倍体,大多不育,存在基因流障碍,长期的无性繁殖以及不科学的人工选育,从而导致了中国水仙种群间遗传多样性贫乏。中国水仙遗传多样性水平低的另一个原因是在长期的自然选择和栽培过程中,其基因组 DNA变异频率低,很难发生自然突变形成新品种,这是导致中国水仙品种稀少的根本原因。越来越多的研究表明,物种遗传多样性贫乏是导致物种沦为濒危种的重要原因(Huang et al.,1998)。通过采用现代生物新技术,如将崇明水仙与其它水仙品种进行体细胞杂交、体细胞融合、多倍体诱导,或通过转基因手段将其它花色基因、抗逆基因转入崇明水仙等,从而获得花期更长、花色多样、花型大、花枝多、抗逆性强的新品种,是进一步对崇明水仙进行研究的目标。
Waddington (1957)曾经提出表观遗传学这一现象,认为在DNA序列不发生变化的条件下,基因表达发生的改变是可以遗传的,这是环境因素和细胞内的遗传物质之间发生交互作用的结果(梁前进, 2007, 生物学通报, 42(10): 4-7)。现代研究发现,表观遗传在植物适应环境变化的过程中起到了重要作用(王迪等, 2008),在不同的环境压力下,植物可能会发生复杂的表观遗传变化。当植物遇到环境压力时,表观遗传的修饰程度会发生改变,这种改变一部分是可以遗传的,一部分会因为压力的去除而在同一代细胞中发生回复。这种现象也能解释崇明水仙和漳州水仙同一起源的说法。由于上百年的地理环境胁迫,以及经历的不同的栽培方法,使得崇明水仙和漳州水仙在表型上产生一些变异,这种变异通过无性繁殖延续下来,而DNA序列上并没有产生变化。表现为崇明水仙叶型较宽大,鲜绿色,商品球鳞茎小、少侧脚。而漳州水仙叶细长且窄,深绿色,多花枝,鳞茎肥大,多侧脚;两者出芽时间、叶片形成时期及抽葶时间较一致;而崇明水仙花期较漳州水仙略长,且花大,香味更浓烈。因此,利用其它分子标记通过对中国水仙种群内更多个体的完整基因组的DNA进行比对,找出特异标记对中国水仙种群进行分类定位还有待进一步深入。
3材料与方法
3.1试验材料
材料均为3年生的水仙种球,由上海崇明百叶水仙花专业合作社。分别是漳州单瓣水仙、漳州重瓣水仙、崇明重瓣水仙、崇明单瓣水仙、状元水仙、洋水仙。洋水仙包括4个品种:胡德山(Narcissus ‘Paricutin’ ‘Mount Hood’),阳光光盘(Narcissus ‘Sun Disc’),帕里库廷火山(Narcissus ‘Paricutin’)和塔希提(Narcissus ‘Tahiti’)。
3.2水仙总DNA提取
采用CTAB法(王慧超等, 2010),0.8%琼脂糖凝胶电泳上检测DNA质量,在紫外可见分光光度计上测定260 nm和280 nm处的吸光值,将符合实验要求的DNA样品稀释至50 ng/μL于-20℃保存备用。
3.3 ISSR反应体系优化
参照陈林姣(2006)提供的20 μL ISSR反应体系。PCR扩增反应在PTC-100TM和PTC-200TM扩增仪上进行。以崇明重瓣水仙DNA为模板,选择单一引物,分别进行单因素优化和正交设计优化,确定崇明水仙ISSR-PCR反应的最佳实验参数。
单因素优化分别设置了:6个DNA模板浓度(分别为5 ng, 10 ng, 20 ng, 30 ng, 40 ng和50 ng)、6个Mg2+浓度(分别为1.0 mmol/L, 1.5 mmol/L, 2.0 mmol/L, 2.5 mmol/L, 3.0 mmol/L和3.5 mmol/L)、6个引物浓度(分别为0.2 μmol/L, 0.3 μmol/L, 0.4 μmol/L, 0.5 μmol/L, 0.6 μmol/L和0.7 μmol/L)、 6个Taq DNA聚合酶浓度(分别为0.4 U, 0.6 U, 0.8 U, 1.0 U, 1.2 U和1.4 U)、6个dNTPs浓度(分别为0.1 mmol/L, 0.15 mmol/L, 0.2 mmol/L, 0.25 mmol/L, 0.3 mmol/L和0.35 mmol/L);比较它们对ISSR反应的影响,均重复两次。此外,实验在40℃~60℃范围内设置了12个退火温度:40.0℃、40.5℃、 41.7℃、43.2℃、45.5℃、48.4℃、51.7℃、54.6℃、56.8℃、58.4℃、59.6℃和60℃,以筛选出最佳退火温度。
正交设计优化对Mg2+浓度、dNTPs浓度、Taq DNA聚合酶浓度、引物浓度4个影响因素用L9(34)正交表设计(表5),每个组合重复2次。

表5 ISSR-PCR优化因素水平表
Table 5 ISSR-PCR optimization factors
3.4 AFLP分子标记
AFLP酶切采用MseⅠ和EcoRⅠ双酶切组合,内切酶、T4DNA连接酶购自NEB公司。AFLP接头、引物、Taq酶购自北京鼎国生物技术公司。反应体系如表6所示。各反应完成后用1.5%的琼脂糖凝胶电泳检测产物。
![]()
表6 AFLP标记反应体系
Table 6 Reaction system of AFLP markers
3.5数据处理
人工读取ISSR、AFLP电泳图,在同一引物、同一位点处,对扩增产生信号较强的、重复性较好的带记为“1”,信号较弱、重复性较差的带或未出现带的记为 “0”,形成0、1矩阵。利用NTSYS统计软件对统计结果进行分析,计算遗传相似系数(GS)。根据遗传相似系数对供试水仙进行分析。
作者贡献
曾艳、周永刚、张冬梅是本研究的实验设计和实验研究的执行人;曾艳完成数据分析,论文初稿的写作,周永刚参与实验设计,试验结果分析;张冬梅是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改;卞黎霞、鲁琳、陆颖是项目的参与者。全体作者都阅读并同意最终的文本。
致谢
本研究为重点科技攻关项目(编号: 10391901400)资助。作者感谢上海崇明百叶水仙花专业合作社在本实验过程中的材料支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商,这并非我们为这些试剂供应商的产品和服务提供推荐或背书。
参考文献
Chen L.J., 2006, Studies on Genetic Diversity of Narcissus tazetta L. var. chinensis Roem and its Meachanism of Sterility, Ph.D. Thesis, Xiamen University, Supervisor: Tian H.Q., pp.24-26 (陈林姣, 2006, 中国水仙遗传多样性及其不育机理研究, 博士学位论文, 厦门大学, 导师: 田惠桥, pp. 24-26)
Huang H., Dane F., and Kubisiak T.L., 1998, Allozyme and RAPD analysis of the genetic diversity and geograpllic variation in wild populations of the America chestnut Castanea dentate (Fagaceae), Am. J. Bot., 85: 1013-1021 http://dx.doi.org/10.2307/2446368
Jiang M., Li X.M., Wen Q., and Ye J.S., 2006, AFLP molecular marker and its application on plants, Jiangxi Linye Keji (Jiangxi Forestry Science and Technology), 5: 41-44 (江梅, 李小梅, 温强, 叶金山, 2006, AFLP标记及其在植物中的应用, 江西林业科技, 5: 41-44)
Jiang X.W., and Zhang Q.X., 2006, AFLP molecular markers in the application of ornamental plants, Caoye Kexue (Pratacultural Science), 23(6): 92-98 (蒋细旺, 张启翔, 2006, AFLP分子标记技术在观赏植物中的应用, 草业科学, 23(6): 92-98)
Waddington C.H., ed, 1957, The strategy of the genes, Allen & Unwin, London, pp.1-32
Wang D., Fu B.Y., and Zhang L.J., 2008, The Plant’s Epigenetic Variation and Response to Environmental Stress, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 6(3): 569-573 (王迪, 傅彬英, 张立军, 2008, 植物表观遗传变化与环境压力研究进展, 分子植物育种, 6(3): 569-573)
Wang H.C., Yang M., and Jiang B., 2010, Study on Extracting Total DNA from Stem Tumorous Mustard, Zhongzi (Seed), 29(2): 77-78 (王慧超, 杨敏, 江波, 2010, 茎瘤芥总DNA提取研究, 种子, 29(2): 77-78)
Wang J.B., 2002, ISSR Markers and their applications in plant genetics, Yichuang (Hereditas), 24(5): 613-616 (王建波, 2002, ISSR分子标记及其在植物遗传学研究中的应用, 遗传, 24(5): 613-616)