作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 117 篇 doi: 10.5376/mpb.cn.2011.09.0117
收稿日期: 2011年09月23日 接受日期: 2011年10月20日 发表日期: 2011年11月25日
引用格式(中文):
关世凯等, 2011, 甘薯近缘野生种Ipomoea cordatotriloba组织及原生质体培养植株再生, 分子植物育种(online) Vol.9 No.117 pp.1851-1856 (doi: 10.5376/ mpb.cn.2011.09.0117)
引用格式(英文):
Guan et al., 2011, Plant regeneration in tissue and protoplast cultures of Ipomoea cordatotriloba, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.9 No.117 pp.1851-1856 (doi: 10.5376/mpb.cn.2011.09.0117)
为通过体细胞杂交法利用甘薯近缘野生种Ipomoea cordatotriloba中的抗茎线虫病基因,本研究建立了该野生种有效的原生质体培养植株再生体系。利用含0.05 mg/L 2,4-D和0.5 mg/L KT的MS培养基诱导甘薯近缘野生种叶柄组织并形成愈伤组织,将诱导得到的愈伤组织在6种不同分化培养基上进行培养。结果表明,在含0.1 mg/L IAA和5.0 mg/L BAP的分化培养基上获得了最高的植株再生率,达52.00%。用所建立的I. cordatotriloba的叶柄组织培养植株再生体系,培养其原生质体再生植株,再生率达50.98%。
甘薯(Ipomoea batatas (L.) Lam.)是世界上重要的粮食、饲料、工业原料以及新型能源用块根作物(刘庆昌, 2004)。由于甘薯组内存在严重的种间杂交不亲和性,使得甘薯近缘野生种的基因资源难以在甘薯育种中直接利用。研究表明,体细胞杂交法是克服甘薯组植物有性杂交不亲和性的有效途径(Guo et al., 2006; Yang et al., 2009)。
为了用体细胞杂交法克服甘薯栽培种与近缘野生种之间的种间杂交不亲和性,首先必须建立其有效的原生质体培养植株再生体系。关于甘薯及其近缘野生种原生质体培养植株再生已经有一些报道。Suga等(1990)培养Ipomoea trifida (白花野牵牛, 2x)的叶肉原生质体,获得20%的植株再生率。Liu等(1991)对Ipomoea triloba (三裂叶野牵牛, 2x) 的叶柄原生质体进行培养,获得36.7%的植株再生率。刘庆昌等(1995)改进培养基中植物生长调节剂的种类和浓度,对I. triloba和Ipomoea lacunosa (多洼野牵牛, 2x) 的叶柄原生质体进行了植株再生研究,从I. lacunosa原生质体获得11株再生植株;实现了I. triloba原生质体的高频率植株再生,达62%。Guo等(2006)从Ipomoea cairica (槭叶野牵牛, 2x) 的叶肉原生质体实现了41.3%的植株再生率。
关于甘薯及其近缘野生种体细胞杂交的研究也有一些报道。刘庆昌等(1994)从甘薯品种高系14号与I. triloba的融合原生质体得到7株种间体细胞杂种植株。刘庆昌等(1998)获得了高系14号和I. lacunosa的2株体细胞杂种植株。Zhang等(2002)获得了甘薯品种栗子香和I. lacunosa的种间体细胞杂种植株。Guo 等(2006)获得了甘薯品种徐薯18和Ipomoea cairica的46株种间体细胞杂种植株。Yang等(2009)获得徐薯18与I. triloba的体细胞杂种植株,并从中筛选出具有膨大块根的抗旱杂种植株。
研究表明,甘薯近缘野生种Ipomoea cordatotriloba (2x)具有抗甘薯茎线虫病的特性(曹清河等, 2009),但由于其与甘薯栽培种杂交不亲和,其抗茎线虫病基因资源难以直接应用于甘薯育种。但是,目前尚未见有关I. cordatotriloba的原生质体培养及体细胞杂交的报道。为通过体细胞杂交法利用I. cordatotriloba中的抗茎线虫病基因资源,首先需要建立其有效的原生质体植株再生体系。本研究在建立I. cordatotriloba 叶柄组织培养植株再生体系的基础上,成功地建立了I.cordatotriloba 的叶柄原生质体植株再生体系,实现了高频率的原生质体植株再生。
1结果与分析
1.1叶柄组织培养及植株再生
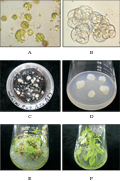
将甘薯近缘野生种I. cordatotriloba 的叶柄组织在添加0.05 mg/L 2,4-D和0.5 mg/L KT的固体MS培养基上进行培养(图1A)。培养4~7 d后,叶柄组织开始形成愈伤组织;培养3~4周后,形成直径约10 mm的愈伤组织(图1B),愈伤组织诱导率为100% (表1)。甘薯近缘野生种I. cordatotriloba 的叶柄组织所形成的愈伤组织较松软,白色,与Liu等(1990)获得的I. triloba 叶柄组织培养结果相似。
将诱导得到的愈伤组织转移到添加0、0.1 mg/L IAA 和1.0、2.0、5.0 mg/L BAP 的6种分化培养基上进行培养。培养7~10 d后,愈伤组织开始变成黄绿色;培养20 d后开始形成不定根。在分化培养基上,只有极少数愈伤组织直接形成不定芽,大多数愈伤组织仅形成不定根。
培养4~6周后,将愈伤组织连同不定芽或不定根一起进一步转移到MS基本培养基上。转移2~3周后,不定芽进一步发育成完整植株(图1C);多数愈伤组织陆续在不定根上再生出植株。在添加 0.1 mg/L IAA 和 5.0 mg/L BAP 的MS固体培养基上培养过的愈伤组织显示了最高的植株再生率达52%,显著高于其他培养基的培养效果(表1)。表明较高浓度的BAP有利于甘薯近缘野生种I. cordatotriloba的愈伤组织植株再生。将再生植株进一步转移到MS基本培养基上,它们发育成完整的再生植株(图1D)。
1.2原生质体培养与植株再生
对甘薯近缘野生种I. cordatotriloba的叶柄组织进行酶解处理后获得大量原生质体(图2A)。这与以前在I. triloba和I. lacunosa中分离叶柄原生质体的结果类似(Liu et al., 1991; 刘庆昌等, 1995)。将甘薯近缘野生种I. cordatotriloba的叶柄原生质体在含有1/2MS无机盐(但不含NH4NO3)、MS维生素类、50 mg/L CH、0.6 mol/L D-甘露醇、0.05 mg/L 2,4-D、0.5 mg/L KT和1% 蔗糖的培养基(pH 5.8, P1培养基)中进行培养。培养1~2 d后,大多数原生质体开始形成新的细胞壁。培养2~3 d后,原生质体开始第一次细胞分裂,之后持续进行分裂形成细胞团。培养2周后,原生质体的植板效率达到50%左右。培养4周后,形成肉眼可见的细胞团(图2B)。
培养4周后,将培养基(P2培养基)的D-甘露醇浓度降至0.3 mol/L,蔗糖浓度增至2%,其他条件不变,继续培养4周后,再培养在含有0.05 mg/L 2,4-D、0.5 mg/L KT和3% 蔗糖的MS培养基(P3培养基)中,细胞团迅速生长。植板10~12周后,原生质体生长成为直径约1~3 mm的小愈伤组织。甘薯近缘野生种I. cordatotriloba的小愈伤组织为白色、结构松软(图2C)。
将直径达到1~3 mm的小愈伤组织转移到增殖培养基上后,愈伤组织增殖迅速。转移3周后,愈伤组织的直径达到5~10 mm, 愈伤组织仍为白色,结构疏松(图2D)。将增殖得到的愈伤组织转移到分化培养基上1周后,愈伤组织开始变绿,陆续长出不定根。在分化培养基上培养4~6周后,将愈伤组织转移到MS基本培养基上进行培养,愈伤组织再生出植株。I. cordatotriloba的原生质体再生植株大部分是从愈伤组织分化的粗根上再生出来的(图2E)。将再生的小植株转移到新鲜的MS基本培养基上进行培养,获得了完整的再生植株(图2F)。
现将I. cordatotriloba的原生质体植株再生结果列于表2中。从表2可以看出,在添加0.1 mg/L IAA和5.0 mg/L BAP的分化培养基上实现了高频率的植株再生,再生率达50.98%,说明叶柄是I. cordatotriloba原生质体分离和培养的适宜供体。
2讨论
建立高效的甘薯及其近缘野生种组织培养植株再生体系是利用体细胞杂交法克服甘薯及其近缘野生种之间杂交不亲和性的前提。甘薯及其近缘野生种的原生质体融合需要大量有活力的甘薯品种及近缘野生种的原生质体,而且还需适合融合原生质体植株再生的培养体系。
前人的研究表明,甘薯近缘野生种的叶柄和叶肉组织是分离和培养原生质体的理想供体,并已经由I. triloba和I. lacunosa的叶柄原生质体以及I. trifida和I.cairica的叶肉原生质体获得了再生植株,特别是实现了I. triloba原生质体的高频率植株再生(Suga et al., 1990; Liu et al., 1991; 刘庆昌等, 1995; Guo et al., 2006)。
甘薯近缘野生种I. cordatotriloba具有抗甘薯茎线虫病的特性(曹清河等, 2009)。本研究在建立甘薯近缘野生种I. cordatotriloba 叶柄组织培养植株再生体系的基础上,成功地建立了I. cordatotriloba 的叶柄原生质体植株再生体系,实现了高频率的原生质体植株再生。这些研究结果为用体细胞杂交法将I. cordatotriloba的抗茎线虫病基因导入甘薯栽培种奠定了基础。
3材料与方法
3.1 植物材料
以甘薯近缘野生种I. cordatotriloba (2n=2x=30) 的离体培养植株作为实验材料,离体培养植株的准备方法参照Liu等(1990)的方法。I. cordatotriloba的种子由江苏徐州甘薯研究中心提供。
3.2甘薯近缘野生种I. cordatotriloba叶柄组织培养及植株再生
取离体培养3周的甘薯近缘野生种I. cordatotriloba的植株,切下状态一致的叶柄,在培养皿上切成3~4 mm长的小段,接种在添加0.05 mg/L 2, 4-D和0.5 mg/L KT的MS固体培养基上,在27±1℃下暗培养,诱导愈伤组织的形成。
培养3~4周后,将形成的愈伤组织转移到分别添加0、0.1 mg/L IAA和1.0 mg/L、2.0 mg/L、5.0 mg/L BAP的6种分化培养基上(表1),在27±1℃、每日13 h、3000 lux光照下进行培养,以诱导不定器官的分化。每种培养基上转移50个愈伤组织,3次重复。转移4~6周后,将具有不定器官的愈伤组织进一步转移到MS基本培养基上,在相同条件下培养,诱导植株再生。用SPSS 13.0软件分析不同分化培养基对植株再生的效果。
3.3甘薯近缘野生种I. cordatotriloba叶柄原生质体培养及植株再生
3.3.1原生质体分离
根据Liu等(1991)的方法,从甘薯近缘野生种I. cordatotriloba离体培养植株的叶柄分离原生质体。
3.3.2原生质体培养及愈伤组织形成
将I. cordatotriloba的原生质体悬浮培养在含2.5 mL培养基P1的直径60 mm玻璃培养皿中,原生质体的培养密度为1~2×104原生质体/mL。用Parafilm将培养皿密封,放在2±l℃的黑暗条件下,采用液体浅层法进行静置培养。每隔4周,将培养物依次转移到培养基P2和P3中,在相同条件下进行培养,以诱导原生质体形成细胞团和愈伤组织。
培养10~12周后,将直径达l~3 mm的小愈伤组织转移到添加0.05 mg/L 2,4-D和0.5 mg/L KT的MS固体培养基上进行培养,使愈伤组织增殖,培养条件为27±1℃、黑暗。
3.3.3植株再生
将增殖得到的愈伤组织转移到分别添加2.0 mg/L BAP、0.1 mg/L IAA和2.0 mg/L BAP、0.1 mg/L IAA和5.0 mg/L BAP的3种分化培养基上,在27±1℃、每日13 h、3000 lux光照下培养,诱导愈伤组织的分化。在分化培养基上培养4~6周后,将愈伤组织进一步转移到MS基本培养基上,在相同条件下培养以诱导植株再生。用SPSS 13.0软件分析不同分化培养基对原生质体植株再生的效果。
作者贡献
关世凯是本研究的实验设计和实验研究的执行人;杨育峰和孙亚萍是本研究的实验设计和实验研究的执行人;翟红和何绍贞参与实验设计,试验结果分析;刘庆昌是论文的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家甘薯产业技术体系(CARS-11)资助。
参考文献
Cao Q.H., Zhang A., Li P., Li H.M., Xie Y.P., Li X.Y., Wang X and Ma D.F., 2009, Identification of the wild elite resistant resources and breeding of novel interspecies hybrids, Zhiwu Yichuan Ziyuan Xuebao (Journal of Plant Genetic Resources), 10 (2): 224-229 (曹清河, 张安, 李鹏, 李洪民, 谢逸萍, 李秀英, 王欣, 马大夫, 2009, 甘薯近缘野生种的抗病性鉴定与新型种间杂种的获得, 植物遗传资源学报, 10 (2): 224-229)
Guo J.M., Liu Q.C., Zhai H. and Wang Y.P., 2006, Regeneration of plants from Ipomoea cairica L. protoplasts and production of somatic hybrids between I. cairica L. and sweetpotato, I. batatas (L.) Lam., Plant Cell Tissue and Organ Culture, 87(3): 321-327
http://dx.doi.org/10.1007/s11240-006-9135-x
Liu Q.C., 2004, Importance of sweetpotato in the security of food and energy in China, Keji Daobao (Science & Technology Review), 9: 21-22 (刘庆昌, 2004, 甘薯在我国粮食和能源安全中的重要作用, 科技导报, 9: 21-22)
Liu Q.C., Kokubu T., and Sato M., 1990, Plant regeneration in stem, petiole and leaf explant cultures of Ipomoea triloba L., Japanese Journal of Breeding, 40(3): 321-327
Liu Q.C., Kokubu T., and Sato M., 1991, Plant regeneration from Ipomoea triloba L. protoplasts, Japanese Journal of Breeding, 41(1): 103-108
Liu Q.C., Mi K.X., Zhou H.Y. Ma B. and Zhai H., 1998, Regeneration and identification of interspecific somatic hybrid plants between sweetpotato and Ipomoea lacunosa, Zuowu Xuebao (Acta Agronomica Sinca), 24(5): 529-535 (刘庆昌, 米凯霞, 周海鹰, 马彪, 翟红, 1998, 甘薯和Ipomoea lacunosa 的种间体细胞杂种植株再生及鉴定, 作物学报, 24(5): 529-535)
Liu Q.C., Wang J.S., Kokubu T. and Sato M., 1995, Plant regeneration from petiole protoplasts of sweetpotato (Ipomoea batatas (L.) Lam.) and its related species, Zuowu Xuebao (Acta Agronomica Sinca), 21(l): 25-28 (刘庆昌, 王晶珊, 国分祯二, 佐藤宗治, 1995, 甘薯 (Ipomoea batatas (L.) Lam.)及其近缘野生种原生质体的植株再生, 作物学报, 21(l): 25-28)
Liu Q.C., Wang J.X., Li W.J. and Zhou H.Y., 1994, Protoplast fusion and regeneration of interspecific somatic hybrid plants between sweetpotato (Ipomoea batatas (L.) Lam.) and its related species, Nongye Shengwu Jishu Xuebao (Journal of Agricultural Biotechnology), 2(1): 85-90 (刘庆昌, 王家旭, 李惟基, 周海鹰, 1994, 甘薯及其近缘野生种的原生质体融合和种间体细胞杂种植株再生, 农业生物技术学报, 2(1): 85-90)
Suga R., Takagi Y. and Okutsu Y., 1990, Protoplast culture of sweetpotato and its related wild species-plant regeneration from leaf protoplasts-derived callus of Ipomoea trifida, Japan. J. Breed., 40 (Suppl.1): 78-79
Yang Y.F., Guan S.K., Zhai H., He S.Z., Liu Q.C., 2009, Development and evaluation of a storage root-bearing sweetpotato somatic hybrid between Ipomoea batatas (L.) Lam. and I. triloba L., Plant Cell Tissue Organ Cult., 99: 83-89
http://dx.doi.org/10.1007/s11240-009-9578-y
Zhang B.Y., Liu Q.C., Zhai H., Wang Y., and Zhang D.P., 2002, Production of fertile interspecific somatic hybrid plants between sweetpotato and its wild relative, Ipomoea lacunosa, Acta Horticulturae, 583: 81-85
.png)