 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 1 篇 doi: 10.5376/mpb.cn.2012.10.0001
收稿日期: 2011年11月18日 接受日期: 2012年01月05日 发表日期: 2012年01月17日
引用格式(中文):
吴锁伟等, 2012, 玉米隐性核雄性不育基因研究进展及其育种应用途径分析, 分子植物育种(online) Vol.10 No.1 pp.1001-1011 (doi: 10.5376/mpb. cn.2012.10.0001)
引用格式(英文):
Wu et al., 2012, Research progress on maize recessive genic male sterility gene and its utilization strategies in maize breeding program, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.1 pp.1001-1011 (doi: 10.5376/mpb.cn.2012.10.0001)
玉米隐性核雄性不育材料是玉米生产和育种中广泛存在的一种特异的种质资源,对玉米杂交育种和杂交种生产都具有极其重要的意义,但是由于这类不育材料缺乏有效的保持和繁殖技术体系,长期以来一直未能在玉米遗传育种和杂交制种过程中得到充分利用。本文拟从玉米隐性核不育基因的研究历史、现状及未来可能的育种应用途径等方面逐一概述,并整合现代生物技术手段和常规杂交育种策略,以期为解决玉米隐性核不育基因的有效育种利用、建立高效的玉米杂交育种体系和降低杂交种制种成本等关键科学和技术问题提供设计思路和理论依据。
植物雄性不育(male sterility, MS)是指在高等植物中,雄性器官发育异常,无法产生有功能的雄配子(花粉),但雌性器官发育正常,能接受正常雄配子而受精结实,并能将该不育性遗传给后代的现象。高等植物的小孢子发育,受到大量基因的协同表达调控,其中某个基因的结构或功能发生突变,都可能导致雄性不育现象。雄性不育现象在高等植物中广泛存在(Kaul, 1988),在玉米、水稻、小麦、棉花、高粱和油菜等主要农作物中都有报道(李竞雄, 1961; 袁隆平, 1966; 邓景扬和高忠丽, 1980; 张天真, 1995; 张孔湉和傅泓仪, 1982; 侯国佐, 2009)。
玉米雄性不育按照不育性遗传方式的差异,可分为3类:细胞质雄性不育、细胞核雄性不育和质核互作雄性不育,其中细胞核雄性不育还可分为显性核不育和隐性核不育,而且以后者为主。由于细胞质母体遗传的原因,细胞质不育基因的F1不能自交结实,因而不能在育种和生产上利用;利用常规杂交育种技术,细胞核雄性不育系的保持和繁殖存在困难,也不能在育种和生产上有效利用;质核互作不育基因,理论和实践上都可以被育种利用,但是该类基因的广泛利用会导致杂交种细胞质单一化,易受专一性病原小种的侵染而导致杂交玉米生产存在巨大的风险。因此,目前国内外玉米杂交育种的父母本大多是可育的自交系,杂交制种时需要对母本进行人工或机械除雄,大大增加了制种成本,同时杂交种纯度也难以得到保障。
随着现代生物技术的快速发展,利用作物分子设计技术,并结合常规育种方法,有望将隐性核不育基因有效利用起来。同时,相对于玉米质核互作不育而言,玉米隐性核不育具有以下育种优势:(1)不育性受核基因控制,不受细胞质影响,不育性稳定;(2)不需要特定的恢复基因,任何自交系和玉米品种都可以是它的恢复系,扩大了杂交组配的种质资源利用率;(3)不存在因细胞质单一化而带来的病原小种专化感染的潜在风险(季良越等, 1997)。因此,玉米隐性核不育材料具有巨大的育种应用潜力,当前关键问题是如何巧妙地设计研究方案,有效地保持和繁殖隐性核不育系。近年来,随着分子生物学和基因工程技术的发展,玉米隐性核不育基因的利用获得了一些重要进展和突破。本文将从玉米隐性核不育基因的研究进展,隐性核不育系的创制策略、利用途径和应用前景等几方面进行阐述,以期为有效地利用玉米隐性核不育材料、提高玉米杂种优势利用效率和建立高效玉米育种体系提供参考依据和研究思路。
1玉米隐性核不育基因的研究现状
1.1目前发现的玉米隐性核不育基因
1921年,Eyster最早报道了玉米的无花粉型突变体,称之为雄性不育(male sterile),定名为ms1,并且通过遗传学方法将其鉴定为单基因控制的隐性核不育类型(Eyster, 1921)。随后的十多年间,其他学者又陆续发现了更多的玉米隐性核雄性不育基因,如ms2、ms3、ms5、ms7、ms8、ms9、ms10、ms11、ms12、ms13、ms14、ms17、ms18、ms19、ms20等(Singleton and Jones, 1930; Eyster, 1931a; 1931b; Beadle, 1932)。上世纪40年代之后,随着质核互作雄性不育系在玉米生产上的广泛应用,核不育基因的研究剧降。但是,由于70年代美国广泛种植的玉米T型胞质不育杂交种遭到了小斑病原T小种的专化侵染,从而造成对美国玉米生产的毁灭性打击,致使核不育的研究重新得到了重视,继而陆续发现了ms22/msca1、ms23、ms24、ms26、ms28、ms29、ms30、ms31、ms32、ms33、ms34、ms35、ms36、ms37、ms38、ms43、ms45、ms50、ms52等新的隐性核不育基因,并且大部分完成了染色体的初步定位和细胞学分析(MaizeGDB, www.maizegdb.org)。近年来,我国玉米工作者通过远缘杂交、太空诱变、辐射诱变等途径,又创造出了一批新的玉米隐性核不育突变体(林晓怡等, 2000; 曹墨菊等, 2000; 李玉玲等, 2007; 罗红兵等, 2008),进一步丰富了玉米隐性核不育基因的种质资源。
1.2玉米隐性核不育基因的定位与克隆研究
20世纪30年代,Singleton和Jones对隐性核不育基因ms1进行了染色体定位研究,通过基因连锁关系测交鉴定技术,首次将ms1基因定位到玉米第6染色体长臂上(Singleton and Jones, 1930)。在早期的基因染色体定位研究中,玉米显性核不育基因主要通过wx基因易位系统进行,而隐性核不育基因则主要通过B-A易位系统进行定位(孔庆泉和荣廷召, 2003)。随着分子生物学技术的快速发展,多种基于DNA序列多态性和PCR技术的分子标记定位方法,如RFLP、AFLP、SSR、SNP等,已经成为基因定位的主要研究方法,并被广泛应用于玉米隐性核不育基因的定位研究(梁业红等, 2000; 刘福霞等, 2005; Tang et al., 2006; 李式昭, 2007)。目前,已经完成染色体定位的玉米隐性核不育基因至少有36个(表1),大部分基因仅仅初步定位到不同的染色体臂上,少数基因通过分子标记进行了遗传作图,如ms30和ms-Sicau,而ms22/msca1、ms26和ms45则完成了克隆测序(表2),并且申请了专利保护(Albertsen et al., 1995; Albertsen et al., 2009; Wu and Hershey, 2011)。ms30和ms-Sicau的连锁分子标记定位结果,一方面可以用于标记辅助选择育种,通过回交转育创制不同遗传背景的隐性核不育系;另一方面可以为最终克隆这些不育基因提供参考依据。而ms22/msca1、ms26和ms45等已经克隆的基因,由于它们在玉米小孢子发育和花粉成熟过程中的功能解析比较清楚,则可以通过转基因技术等手段,把育性恢复基因转化到相应的隐性核不育系中,从而创制可以保持和繁殖的新型不育系(具体原理详见本文4.4部分)。
|
表1 玉米隐性核不育基因的染色体定位结果
注: 原始数据来源于MaizeGDB网站(http://www.maizegdb.org/); *: 不育系材料已经丢失; **: 四川农业大学发现的太空诱变隐性核不育基因(曹墨菊等, 2000; 刘福霞等, 2005) Table 1 Chromosome mapping results of the RGMS genes in maize Notes: The data come from MaizeGDB website (http://www.maizegdb.org/); *: The sterile germplasm lost; **: The RGMS gene found by Sichuan Agricultural University (Cao et al., 2000; Liu et al., 2005) |
|
表2 已用分子标记定位或克隆的玉米隐性核不育基因
Table 2 The RGMS genes mapped and/or cloned by using molecular markers |
2创制玉米隐性核不育材料的技术策略
自从1921年Eyster首次发现玉米的隐性核不育突变体以来,已经发现了大量的玉米隐性核不育基因或材料。但是由于缺乏有效的不育性保持和繁殖技术体系,国内外玉米工作者一直无法在玉米杂交育种中直接应用隐性核不育系;然而随着现代生物技术的发展,借助转基因技术可以有效地将隐性核不育系应用到杂交育种工作中。因此,创造更多的隐性核不育系和不育基因,对杂交玉米育种意义重大。以往获得隐性核不育基因的途径,包括天然突变、辐射诱变、太空诱变等,都需要从大群体中筛选目标突变体,随机性强,成功率很低;然而通过现代生物技术,定点突变某些控制花粉育性的关键基因,有望快速创制一系列新的雄性不育突变体。
2.1获得玉米隐性核不育材料的传统途径
2.1.1天然突变
天然突变是指生物不经任何人工处理,在自然条件影响下产生的可遗传的突变,又叫自发突变。目前所发现的玉米隐性核不育材料,大部分都是天然突变体。例如ms30基因就是李竞雄等在研究甜玉米材料时发现的一个天然突变体,通过B-A易位系把该基因定位在第4染色体上,距离玉米甜质基因su为11-19个交换单位(李竞雄, 1998; 梁业红等, 2000)。另外,林晓怡等(2000)在玉米族远缘杂交组合3402F3(丹340×40322)中首次发现带标记性状的核雄性不育突变材料,遗传分析表明,其不育性受一对隐性基因控制,不育基因与多花丝的标记性状基因完全连锁。
2.1.2辐射诱变
辐射突变是指利用χ、γ、α、β射线和中子、紫外光等辐射处理生物体,诱发遗传物质的改变,使后代出现新的变异类型。罗红兵等(2008)利用30Gy的7Li离子辐射玉米杂交种农大108种子,从M3代材料中获得了雄性不育突变材料39I3-2,遗传分析结果表明,不育材料39I3-2花粉败育彻底,不育性状表现稳定,呈现出隐性单基因控制的核不育遗传特点。未辐照的农大108的自交后代没有发现雄性不育现象,从而证明该不育突变体是由重离子辐射诱导产生的基因突变结果。同时,他们还通过重离子辐射玉米自交系478,经过系统选育从辐射后代材料中分离获得了细胞质雄性不育材料,进一步证明重离子辐射作为一种新的诱变育种手段可以应用于作物遗传改良和种质创新。
2.1.3太空诱变
太空诱变是指利用太空所特有的环境条件,如微重力、强宇宙射线、高真空、重粒子、超洁净及交变磁场等因素,诱发农作物产生的变异类型。曹墨菊等(2000)通过对卫星搭载的6份优良玉米材料的后代进行筛选,从中选育得到了一个隐性核雄性不育突变体,田间雄花育性表现稳定,花粉彻底败育,证实为无花粉型不育系。李玉玲等(2007)从搭载神舟4号飞船的4份玉米自交系后代中选育出了两个雄性不育突变体,育性鉴定和遗传分析表明,这两个不育突变体均为无花粉型不育系,雄花败育彻底。不育性状在不同年份、不同季节、不同地点可以稳定遗传,属于可遗传的单基因控制的隐性核不育类型。
2.2 隐性核不育基因的定点突变策略
无论是天然突变,还是人工诱变,都是一种被动的、低效的技术策略。随着现代分子生物学技术的发展,科学家发明了多种高效的定点突变技术,其中最具有代表性的是锌指核酸酶(zinc finger nucleases, ZFN)技术,并且在动植物上都获得了成功应用(Wu et al., 2007; 张余洋等, 2008; Weinthal et al., 2010; 肖安等, 2011)。
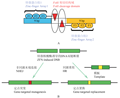
ZFN是一种人工改造的核酸内切酶,包括一个锌指蛋白(zinc-finger protein, ZFP)DNA结合域和一个非特异性的Fok I剪切结构域 (图1A, Kim et al., 1996)。其工作原理是ZFP能够识别并结合特异的DNA序列,与之相连的Fok I随之通过形成二聚体发挥内切酶的剪切功能,在结合位点附近产生DNA双链断裂(Double-strand break, DSB),从而激活非同源末端连接(Non-homologous end joining, NHEJ )或同源重组(Homologous recombination, HR)机制,导致定点突变或定点置换的发生。当ZFN进行基因组DNA定点切割时,如果不存在同源性模板,ZFN诱导的DSB往往通过非同源末端连接,引发基因定点突变;如果存在一个具有一定同源性的DNA为模板,则可以通过同源重组机制实现DNA的定点置换(图1B)。
|
图1 锌指核酸酶(ZFN)结构及工作原理
注: A: ZFN的结构示意图; B: ZFN通过非同源末端连接和同源重组介导的基因定点突变及定点置换示意图 Figure 1 The structure and working model of zinc-finger nuclease (ZFN) Note: A: Schematic of ZFN Structure; B: Schematic representation of gene-targeted mutagenesis and replacement mediated by ZFN through NHEJ and HR methods, respectively |
ZFN的DNA结合域一般由3~6个Cys2-His2类型锌指蛋白串联而成,每个锌指蛋白识别并特异结合DNA双螺旋的一个单链上的三联体碱基序列。由多个锌指蛋白串联形成的锌指蛋白组(Zinc Finger Array),可以识别一段更长的特异碱基靶序列,从而具有更强的DNA结合特异性。每个锌指蛋白组大约由30个氨基酸组成,并折叠成α-β-β型的二级结构,其中α螺旋可插入到DNA双螺旋的大沟中,它的-1~+6位氨基酸残基决定锌指蛋白对DNA序列的结合特异性。当改变决定DNA结合特异性的氨基酸时,ZFA可以获得新的DNA结合特异性(Dreier et al., 2011)。因此,ZFN不仅具有良好的DNA识别特异性,还具有较好的可塑性,已成为颇具潜力的DNA定点修饰工具。ZFN中的非特异性剪切结构域一般由Fok I核酸内切酶 C端96个氨基酸残基组成, 而Fok I只有在二聚体状态时才有酶切活性,从而有效防止ZFN单体发挥剪切作用而造成的脱靶(off-target)效应。当两个ZFN的Fok I单体分别通过ZFA对各自目标DNA序列进行特异结合、且在DNA双链上形成5~7bp的间隔区时,两个Fok I剪切结构域二聚体化而发挥酶切活性,对DNA间隔区进行定点切割(图1A, Kim et al., 1996; Miller et al., 2007)。
ZFN技术已经在包括玉米在内的多种植物内源基因的定点修饰上获得了成功应用。Shukla等(2009)通过ZFN技术定点突变了玉米内源基因IPK1,同时通过同源重组定向引入PAT基因。由于IPK1编码一个控制植酸盐生物合成的关键激酶,而PAT基因是抗除草剂基因,从而不但降低了玉米植酸盐积累水平,并且使玉米获得了除草剂抗性。随着玉米基因组测序计划的完成,许多玉米育性基因的序列信息很容易从公共数据库(如http://www.maizegdb.org/)中获得,因此通过设计相关育性基因的特异性ZFN,利用转基因技术,有望实现定点突变玉米育性关键基因,从而高效的创造一系列的玉米核不育系。
3玉米隐性核不育基因利用途径的传统育种技术探索
玉米隐性核不育基因研究的最终目的是将隐性核不育性状应用到玉米杂交育种和杂交制种工作中(Paterson, 1973)。隐性核雄性不育基因育种利用的最大难点是不育性的保持和繁殖问题,为了能够使核不育基因得到育种利用,必须找到核不育后代早期诊断不育性的标记性状从而尽早区分核不育系。因此,从发现玉米隐性核不育材料时起,人们就利用传统育种技术途径,对核不育基因进行了多种标记性状的探索研究,揭开了玉米隐性核不育基因在玉米生产中应用研究的序幕。
3.1黄白粒系统
科研工作者最早想到的策略是利用玉米第6染色体长臂上的不育基因ms1和控制白色胚乳基因y 之间的紧密连锁关系,通过籽粒颜色判断不育系,进而利用不育系生产杂交种(Singleton and Jones, 1930)。其工作思路是利用紧密连锁的白色胚乳基因y与不育基因ms1之间存在的很低的重组率,通过遗传重组将它们连锁在一起,达到通过籽粒颜色来区分可育种子和不育种子的目的:白粒为不育系,黄粒为保持系。但是,由于ms1和y基因并非完全连锁(交换值在5%以上),在白粒不育系中仍有5%左右的可育株需要人工去雄;而且人们对籽粒颜色的观察判断往往存在差异,往往导致不育系人为混杂;此外,杂交种后代的黄白粒分离现象也会降低玉米的商品品质。因此,通过黄白粒连锁选择不育系的方法,未能在生产上得到推广应用。
3.2双杂合体系统
Patterson(1973) 首次提出的双杂合体法是隐性核不育基因育种利用的又一种尝试。双杂合体是指玉米隐性核不育基因的杂合状态(Ms/ms)和重复-缺失染色体与正常染色体的杂合状态的复合体。该方法的工作原理是首先通过细胞遗传学技术创造玉米隐性核雄性不育基因的双杂合体保持系,然后利用玉米雌、雄配子对重复-缺失染色体敏感程度的差异,来达到保持隐性核不育性的目的。重复-缺失染色体能通过雌配子传递给后代而不能通过雄配子传递,因此双杂合体可产生可育的ms花粉和可育的ms及Ms卵子。用双杂合体保持系的花粉给隐性核不育系(msms)授粉,便可得到全部为雄性不育的后代,而双杂合体保持系通过自交可以得到保存和繁殖。这种方法虽然解决了隐性核不育系保持和繁殖的问题,但由于重复-缺失染色体带来的不平衡效应,双杂合体保持系生活力弱,种子小,影响玉米的杂种优势利用效率;其次是双杂合体保持系转育过程复杂、周期长、技术条件要求很高,也限制了其推广应用。我国也有学者尝试过通过双杂合体法保持和繁殖核不育系(刘仲元, 1982; 季良越等, 1993; 1997),但至今未见在生产上大面积应用。
3.3多花丝标记系统
玉米隐性核不育基因的多花丝标记系统是由中国科学院遗传发育所的林建兴研究员首次提出的(林晓怡等,2000)。他们通过筛选玉米族远缘杂交组合后代,首次发现了带标记性状的隐性单基因控制的核雄性不育突变材料,不育基因与多花丝的标记性状基因完全连锁,不育系植株开花期表现为果穗花丝多两倍,并且成熟果穗的籽粒基部两侧有两个败育的干瘪种子等连锁性状,因此通过穗部的连锁性状比较容易将不育系选出,将不带标记性状种子的果穗淘汰, 留下带标记性状的果穗作为繁种或制种用,使核不育系在育种上的应用往前推进了一步。但是,由于核不育后代的育性分离只有在开花时才能表现出来,并且不能彻底解决人工去雄的问题,因而无法在玉米杂交制种中广泛应用。
3.4黄绿苗标记系统
黄绿苗标记法的设计思路是由李竞雄最早提出的(周洪生, 1996),其工作原理是通过遗传杂交和重组将玉米黄绿苗基因(v)与雄性不育基因导入到同一优良自交系中,并实现二者紧密连锁,在3~4叶期幼苗叶片表现出黄绿颜色差别时,通过拔除正常绿苗即可剔除可育株,而剩余的黄绿苗就是不育系,从而解决了不育系的保持问题。但存在的问题是,在制种时必须倍量播种以保证足量的黄苗,造成前期幼苗生长势弱;并且黄绿苗基因与雄性不育基因也不是完全连锁,而且叶色易受其它因素影响导致误判,故其在生产上也没能推广应用(周洪生, 1996; 孔庆泉和荣廷召, 2003)。
3.5光温敏不育系统
近二十年来,我国在水稻上发现了许多光温敏核雄性不育材料, 使水稻“两系法”杂种优势利用取得了可喜的进展(袁隆平, 1990)。1992年,赫忠友首次发现了玉米温敏雄性不育突变株(琼6Qms),在雄穗发育的特定时期,不同的温度条件能导致雄花育性发生转换:高温(25℃以上)条件导致雄穗花药发育不良,花粉败育,内外颖呈闭合状态;低温(25℃以下) 条件导致雄穗正常开花散粉(赫忠友等,1995,作物杂志,(2):1-23)。这一特性受两对隐性核基因(tms1和tms2)控制并能稳定遗传(付志远等, 2004)。后来,Tang等(2006) 从自交系414育种圃中发现了一个隐性单基因(tms3)控制的温敏不育系琼68Qms,并且利用SSR标记将其定位于玉米的第2染色体上,位于umc2402和umc1042之间,遗传距离分别为3.7 cM和1.5 cM,可以用于标记辅助选择育种。此外,1994年周洪生等发现了光敏核雄性不育材料CA507,遗传分析表明该材料的不育性可能受到4对以上隐性基因控制,且对光周期敏感:短日照条件下表现为雄性不育,长日照条件下表现为雄性可育(邓迎海和周洪生, 1998)。玉米育种家通过常规的杂交育种程序,可将光温敏不育基因导入不同优良自交系,以育成不同遗传背景的光温敏核不育系,从而有望为玉米“两系法”杂种优势利用开辟一条新的途径。但是,由于光温敏雄性不育系易受环境因素影响,育性不稳定,在玉米制种过程中存在较大风险。
综上所述,在玉米隐性核不育系的育种应用上,前期传统技术的探索存在着标记性状不完全连锁、诊断时期滞后、杂种优势不强、育性不稳定等诸多问题,因此都没有在玉米育种和杂交种生产中广泛应用。随着生物技术的快速发展,通过转基因技术和传统育种方法相结合,有望真正解决玉米隐性核不育系的保持和繁殖问题,将其应用到杂交玉米的育种实践,大大提高玉米杂种优势利用效率和杂交制种水平。
4玉米隐性核不育系有效保持、繁殖和育种应用的生物技术途径探索
4.1利用转基因技术解决玉米隐性核不育系的有效保持问题
随着分子生物学的发展,部分隐性核不育系的育性控制机理逐渐被阐明,核不育基因及其相应的育性恢复基因被成功克隆(Albertsen et al., 1995; 2009; Wu and Hershey, 2011),因此可以通过转基因的方法恢复该不育系的育性。最先用到的策略是利用诱导型启动子驱动的育性恢复基因(Ms)转化隐性核不育系(Albertsen et al., 1995)。诱导性调控元件是能够应答于诱导剂直接或间接激活下游基因表达的DNA序列。当不存在诱导剂时,目标基因(Ms)不能被转录,因此育性恢复基因编码的蛋白质(Ms)以非活性形式存在,转基因植株表现为不育系性状;当存在诱导剂时,目标基因(Ms)被转录激活,因此目标蛋白(Ms)转化为有功能的活性形式,转基因植株表现为雄性可育的保持系性状,可以自交结实。这里的诱导剂可以是化学试剂,如蛋白质、代谢产物、生长调控因子、除草剂等,也可以通过热、冷、盐或毒性元素施加的生理胁迫等,主要取决于所用的诱导性调控元件类型(Albertsen et al., 1995; 2009)。
4.2利用荧光蛋白技术解决转基因技术的标记性状问题
转化载体一般包含筛选基因或者报告基因,用于选择经过转化的植物细胞或组织。转基因技术的筛选标记基因一般是赋予受体抗生素抗性或除草剂抗性基因,常用的如卡那霉素抗性基因(NPTII)、潮霉素抗性基因(Hyp)、草甘膦抗性基因(aroA)和草丁膦抗性基因(Bar)等(Frame, 2006)。但是,这些筛选基因的抗性性状只能在转基因后代生长过程中表现出来,而不能在种子阶段进行筛选,诊断时期滞后,因此独立作为不育基因的连锁标记不太合适。而作为转基因植物报告基因的荧光蛋白,如绿色荧光蛋白基因(GFP)、红色荧光蛋白基因(RFP)、青色荧光蛋白基因(CFP)和黄色荧光蛋白基因(YFP)等(Chalfie et al., 2004),可以使转基因植物细胞具有特异的颜色,因此可以通过荧光显微镜来选择。如果这些荧光蛋白报告基因在种子特异表达启动子的调控下,则可以在种子阶段通过荧光的有无筛选不育系和保持系(转基因种子),从而大大提高转基因植株的选择效率。
4.3利用花粉失活策略解决转基因技术的基因漂移问题
目前,针对转基因作物的最大争议在于其可能产生的生态危险—基因漂移问题。而对于开花作物而言,最佳的解决方案就是利用转基因作物的雄性不育技术,使转基因元件不能通过花粉传播(Daniell, 2002)。具体方案为使目标转基因与干扰花粉形成或花粉功能的基因相连,如细胞毒素基因、甲基化酶基因和生长抑制基因等。此外,特异干扰花粉中淀粉的正常积累或者影响花粉中淀粉渗透平衡的基因也可以,如使用雄性组织优先型启动子调控下的玉米a-淀粉酶-1基因(ZmAA1),导致花粉粒能量来源崩溃以及花粉发育被遏制而产生不育(Young et al., 1994)。
4.4转基因技术与传统育种技术的完美结合—SPT技术
近年来,美国杜邦先锋公司发明了一种新型杂交种子生产技术体系—SPT (Seed production technology)技术,综合利用了转基因技术、荧光蛋白筛选技术和花粉失活技术策略,有效地解决了玉米隐性核雄性不育系的保持和繁殖问题(Hondred et al., 2009)。其设计思路是利用现代生物技术,将玉米花粉育性恢复基因、杀花粉基因和红色荧光蛋白标记基因组合在一起,构建遗传转化载体,通过转基因技术,导入到玉米隐性核雄性不育系中,从而恢复不育系的育性并能有效繁殖,实现一系两用的目的(图2)。该转基因株系自交后,产生50%的不育系种子(非红色荧光种子)和50%的保持系种子(红色荧光种子),通过机械色选技术有效地将这两部分种子分离,正常颜色种子可以繁殖为不育系,用于玉米杂交育种和杂交制种;红色荧光种子自交产生其本身和正常颜色不育系种子。
|
图2 通过转基因技术实现对隐性核不育系的有效保持、繁殖的原理图
注: A: 转化载体核心元件结构图; B: 通过转基因技术实现隐性核不育系的保持和繁殖的原理示意图 Figure 2 Maintaining and propagation of RGMS lines through transgenic technology Note: A: Structure of the transgenic construct pSPT; B: Schematic representation on maintaining and propagation of RGMS lines through transgenic technology |
通过分析公开的文献资料,我们认为实现SPT技术的前提包括:(1)获得玉米隐性核不育系的花粉育性恢复基因。如前所述,目前成功克隆的玉米隐性核不育基因非常有限,仅有ms22、ms26和ms45三个,且都是被杜邦先锋公司克隆并专利保护的。但是,目前国内外的玉米隐性核不育材料非常丰富;同时,随着玉米基因组测序工作的进展,大量的基因序列和分子标记信息为克隆相关不育基因奠定了有力的技术和信息基础。(2)建立高效的玉米遗传转化技术体系。实现SPT的关键技术手段是转基因技术,而且理想的转基因株系需要从成千上万的转基因事件优选而来,因此,高效的玉米转化技术体系是必要条件。目前,国际上玉米遗传转化效率普遍较低(Frame, 2006),转化受体仅适于有限的几种基因型(如HiII、A188等),因此急需建立一种高效的玉米遗传转化技术体系。(3)具有优势互补、结构合理的人才队伍。实现SPT的整个过程,需要分子标记技术、基因克隆、载体构建、遗传转化、回交转育、生物安评等多方面的人才协作完成,是现代分子生物学技术和经典遗传育种的完美结合,对人才队伍的层次性、互补性、协作性要求很高。这是目前大多数科研院所和高校的课题组不能独立完成的,必须依靠大型的生物技术或种业公司。随着国家对国内种业公司转基因技术生物育种的加大支持,目前已经有部分实力较强的企业在这方面进行尝试,希望很快能够看到具有完全自主知识产权的玉米SPT技术在国内企业产业化,为中国玉米的杂种优势高效利用和整个玉米产业的快速发展做出贡献。
5结语与展望
玉米是杂种优势利用的最好的作物之一。在培育高产、优质玉米杂交新品种的基础上,提高种子纯度、降低制种成本是当前玉米生产上急待解决的问题,而利用雄性不育系制种是提高玉米杂交种质量最为有效的途径之一。迄今,利用玉米的核质互作雄性不育系进行“三系法”制种,已获得了一定的成功。“三系法”主要利用玉米的质核互作雄性不育性,实施不育系、保持系和恢复系三系配套技术,限制了杂交育种的资源利用率。同时,存在因细胞质的单一化而容易遭受某些致病小种的毁灭性侵染的潜在风险。而依赖于光温敏不育系的“两系法”制种虽然在水稻上取得了成功,但是在玉米上由于存在育性不稳定、易受光温环境影响等不利因素,尚未见大面积利用。因此,建立一套遗传可控的、不受环境影响的玉米核雄性不育技术体系,对玉米优异杂交新品种培育和杂交种高效、低成本、无风险制种,具有重大意义。
玉米隐性核雄性不育材料是一种优异的种质资源,但是由于纯合隐性核雄性不育系无法繁殖和保持等问题,这类材料在实际生产上很少利用。尽管科研工作者通过传统育种技术对其进行了多方面的理论研究和应用尝试,如利用标记性状与不育基因的紧密连锁关系,开发了粒色标记系统法、黄绿苗连锁标记法和多花丝连锁标记体系等,但是由于标记性状与不育基因连锁不完全、标记性状鉴定困难、鉴定时期滞后等问题,这些探索性方法在玉米生产上并没有得到推广应用。
随着现代生物技术的迅速发展,部分玉米隐性核雄性不育材料的不育机理逐渐明确,为分子设计创制稳定的玉米核雄性不育系奠定了理论基础。通过转基因技术和传统育种技术相结合,有望培育非转基因的核雄性不育系,实现隐性核不育系材料的有效保持和繁殖,从而建立一套基于玉米隐性核不育系的高效杂交育种技术体系,提高玉米杂种优势利用率,为确保我国种业乃至国家粮食安全提供科技支撑。
此外,上述的基于转基因技术的分子设计思路在玉米上获得成功后,也可以推广到其它作物中,如水稻、小麦、油菜等,开创我国主要农作物杂交育种新途径,整体提升我国民族种业的科技创新能力和核心竞争力。
作者贡献
吴锁伟完成文献检索、论文初稿的写作及修改;方才臣、邓联武参与论文设计及文字、图片修改;万向元是本项目的负责人,指导论文设计、写作与修改。全体作者阅读并同意最终的文本。
致谢
本研究由国家重点基础研究发展计划课题(2010CB35702; 2012CB723703)和北京市科委科技计划项目(Z111100066111002)的共同资助
参考文献
Albertsen M.C., Beach L.R., Howard J., and Huffman G.A., 1995, Nucleotide sequences mediated male fertility and method of using same, United States Patent, US005478369A
Albertsen M.C., Fox T., Trimnell M., Wu Y., Lowe K., Li B., and Faller M., 2009, Msca1 nucleotide sequences impacting plant male fertility and method of using same, United States Patent, US20090038027A1
Beadle G.W., 1932, Genes in maize for pollen sterility, Genetics, 17: 413-431
Cao M.J., Rong T.Z., and Pan G.T., 2000, The primary identification of maize genic male sterility obtained by space flight, Sichuan Nongye Daxue Xuebao (Journal of Sichuan Agricultural University), 18(2): 100-103 (曹墨菊, 荣廷昭, 潘光堂, 2000, 卫星搭载获得玉米基因雄性不育的初步鉴定, 四川农业大学学报, 18(2): 100-103)
Chalfie M., Tu Y., Euskirchen G., Ward W.W., and Prasher D.C., 1994, Green fluorescent protein as a marker for gene expression, Science, 263: 802-805
Chaubal R., Anderson J.R., Trimnell M.R., Fox T.W., Albertsen M.C., and Bedinger P., 2003, The transformation of anthers in the msca1 mutant of maize, Planta, 216: 778-788
Daniell H., 2002, Molecular strategies for gene containment in transgenic crops, Nature Biotechnology, 20: 581-585
Deng J.Y., and Gao Z.L., 1980, The use of a dominant male sterile mutant in wheat breeding, Zuowu Xuebao (Acta Agronomica Sinica), 6(2): 84-98 (邓景扬, 高忠丽, 1980, 小麦显性雄性不育基因的发现与利用—太谷核不育小麦鉴定总结, 作物学报, 6(2): 84-98)
Deng Y.H., and Zhou H.S., 1998, The utilization of genic-male sterility genes in maize, Yumi Kexue (Maize Science), 2: 1-5 (邓迎海, 周洪生, 1998, 玉米雄性不育基因的利用, 玉米科学, 2: 1-5)
Dreier B., Beerli R.R., Segal D.J., Flippin J.D., and Barbas C.F., 2001, Development of zinc finger domains for recognition of the 5′-ANN-3′ family of DNA sequences and their use in the construction of artificial transcription factors, J. Biol. Chem., 276(31): 29466-29478
Eyster L.A., 1921, Heritable characters of maize. VII. Male sterile, Journal of Heredity, 12:138-141
Eyster W.H., 1931a, Heritable characters of maize. Male sterile, Journal of Heredity, 22: 99-102
Eyster W.H., 1931b, Heritable characters of maize. XXXIX. Male sterile-3, Journal of Heredity, 22: 117-119
Frame B.R., McMurray J.M., Fonger T.M., Main M.L., Taylor K.W., Torney F.J., Paz M.M. and Wang K., 2006, Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts, Plant Cell Rep., 25: 1024-1034
Fu Z.Y., Zhao G.Y., Tang J.H., Hu Y.M., He Z.Y., and He J., 2004, Comparison about traits related to fertility between two maize thermo-sensitive genic male sterile lines and primary mapping the genes for TGMS, Mol. Plant Breed., 2: 633-636 (付志远, 赵广远, 汤继华, 胡彦民, 赫忠友, 赫晋, 2004, 两种玉米温敏不育系的育性相关性状的比较及不育基因的初步定位, 分子植物育种, 2: 633-636)
Hondred D., Young J.K., Brink K., Crowgey E., Dietrich N., and Zhong C.X., 2009, Plant genomic DNA flanking SPT event and methods for identifying SPT event, United States Patent, US20090210970A1
Hou G.Z., ed., 2009, Oil seed recessive nuclear male sterility: study and utilization, Science and Technology Literature Press, Beijing, pp.1-277 (侯国佐, 2009, 油菜隐性核不育研究与利用, 科技文献出版社, 北京, pp.1-277)
Ji L.Y., Ji H.Q., Luo F.H., Hu Y.M., and Huang X.L., 1997, The study on breeding recessive neuclear male-sterile maintainers in maize II.raising the viability of maintainer, Yichuan (Hereditas), 19(6): 1-6 (季良越, 季洪强, 罗福和, 胡彦民, 黄西林, 1997, 玉米隐性核不育双杂合保持系的选育II:提高保持系活力的研究, 遗传, 19(6): 1-6)
Ji L.Y., Luo F.H., Chen W.C., Hu Y.M., and Ji H.Q., 1993, A study on breeding corn genetic male sterile double heterozygous maintainer, Zuowu Xuebao (Acta Agronomica Sinica), 19(3): 262-267 (季良越, 罗福和, 陈伟程, 胡彦民, 季洪强, 1993, 玉米基因雄性不育双杂合保持系的选育研究, 作物学报, 19(3): 262-267)
Kaul M.L.H., ed., 1988, Male sterility in higher plants. Berlin Spinger-Verlag Press, Berlin, Germany, pp.887-892
Kim Y.G., Cha J., and Chandrasegaran S., 1996, Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain, Proc. Natl. Acad. Sci., USA, 93(3): 1156-1160
Kong Q.Q., and Rong T.Z., 2003, Study on genic male sterility in maize and use in molecular breeding, Zhiwuxue Tongbao (Chinese Bulletin of Botany), 20(2): 248-253 (孙庆泉, 荣廷召, 2003, 玉米核雄性不育材料的研究及其在分子育种中的利用, 植物学通报, 20(2): 248-253)
Li J.X., 1961, Utilization of maize male sterility and its restoration in corn double hybrid, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 6: 19-24 (李竞雄, 1961, 玉米雄花不孕性及其恢复性在玉米双交种中的应用, 中国农业科学, 6:19-24)
Li J.X., Zhou H.S., and Sun R.J., eds, 1998, Maize male sterility biology, China Agriculture Press, Beijing, pp. 67-154 (李竞雄, 周洪生, 孙荣锦, 1998, 玉米雄性不育生物学, 中国农业出版社, 北京, pp.67-154)
Li S.Z., 2007, Cytological observation and SSR mapping of genetic male sterile mutant induced by space flight in maize, Thesis for M.S., Sichuan Agricultural University, Supervisor: Cao M.J., pp.24-30 (李式昭, 2007, 太空诱变玉米核不育材料的细胞学观察及不育基因的SSR定位, 硕士学位论文, 四川农业大学, 导师: 曹墨菊, pp.24-30)
Li Y.L., Yu Y.L., Liu Y.X., Li X.H., and Fu J.F., 2007, Genetic study on two maize male sterile mutants obtained by space mutagenesis, Yichuan (Heredita), 29(6): 738-744 (李玉玲, 余永亮, 刘艳霞, 李学慧, 付家锋, 2007, 两份太空诱变玉米雄性不育突变体的遗传研究, 遗传, 29(6): 738-744)
Liang Y.H., Zhou H.S., and Jiang W.R., 2000, RFLP mapping of a male sterile gene (ms30) in maize, Zuowu Xuebao (Acta Agronomica Sinica), 26 (3): 266-270 (梁业红, 周洪生, 蒋琬茹, 2000, 玉米雄性不育基因(ms30)的RFLP作图, 作物学报, 26(3): 266-270)
Lin X.Y., Yang D.E., and Lin J.X., 2000, The discovery, inheritance and utilization of genic male sterility with genetic marker in maize, Zuowu Xuebao (Acta Agronomica Sinica), 26(2): 129-133 (林晓怡, 杨典洱, 林建兴, 2000, 带遗传标记的玉米基因雄性不育的发现及遗传和利用研究, 作物学报, 26(2): 129-133)
Liu F.X., Cao M.J., Rong T.Z., and Pan G.T., 2005, Locating maize male sterility gene induced by space flight using microsatellite markers, Yichuan Xuebao (Acta Genetica Sinica), 32(7): 753-757 (刘福霞, 曹墨菊, 荣廷昭, 潘光堂, 2005, 用微卫星标记定位太空诱变玉米核不育基因, 遗传学报, 32(7): 753-757)
Liu Z.Y., 1982, The study of two lines method in maize (first report): Breeding for nucleus male sterility of maintenance-double heterozygote in maize, Yichuan Xuebao (Acta Genetica Sinica), 9(1): 78-84 (刘仲元, 1982, 玉米两系法的研究(初报):细胞核雄性不育系的保持系—双杂合体的选育, 遗传学报, 9(1): 78-84)
Luo H.B., Zhao K., Zhou W.X., Ni M.N., Tu N.M., and Kong F.Q., 2008, Genetic study on male sterile mutant of maize induced by heavy ion irradiation, Henong Xuebao (Journal of Nuclear Agricultural Sciences), 22(3): 296-299 (罗红兵, 赵葵, 周文新, 倪媚楠, 屠乃美, 孔福全, 2008, 重离子辐射诱导玉米雄性不育突变系的遗传研究, 核农学报, 22(3):296-299)
Miller J.C., Holmes M.C., Wang J.B., Guschin D.Y., Lee Y.L., Rupniewski I., Beausejour C.M., Waite A.J., Wang N.S., Kim K.A., Gregory P.D., Pabo C.O., and Rebar E.J., 2007, An improved zinc-finger nuclease architecture for highly specific genome editing, Nat. Biotechnol, 25(7): 778-785
Paterson E.B., 1973, Genetic male sterility and hybrid maize production, In: Proceedings of the seventh meeting of Eucarpia: maize and sorghum section, Part I, Agreb, Yugoslovia
Shukla V.K., Doyon Y., Miller J.C., DeKelver R.C., Moehle E.A., Worden S.E., Mitchell J.C., Arnold N.L., Gopalan S., Meng X., Choi V.M., Rock J.M., Wu Y.Y., Katibah G.E., Zhifang G., McCaskill D., Simpson M.A., Blakeslee B., Greenwalt S.A., Butler H.J., Hinkley S.J., Zhang L., Rebar E.J., Gregory P.D., and Urnov F.D., 2009, Precise genome modification in the crop species Zea mays using zincfinger nucleases, Nature, 459:437-441
Singleton W.R., and Jones D.F.J., 1930, Heritable characters of maize. XXXV. Male sterility, Journal of Heredity, 21: 266-268
Tang J.H., Fu Z.Y., Hu Y.M., Li J. S., Sun L. L., and Ji H. Q., 2006, Genetic analyses and mapping of a new thermo-sensitive genic male sterile gene in maize, Theor. Appl. Genet., 113: 11-15
Weinthal D., Tovkach A., Zeevi V., and Tzfira T., 2010, Genome editing in plant cells by zinc-finger nucleases, Trends in plant science, 15(6): 308-321
Wu J., Kandavelou K., and Chandrasegaran S., 2007, Custom-designed zinc-finger nucleases: what is next? Cellular and Molecular Life Sciences, 64: 2933-2944
Wu Y., and Hershey H., 2011, Nucleotide sequences mediating male fertility and method of using same, United States Patent, US20110173725A1
Xiao A., Hu Y.Y., Wang W.Y., Yang Z.F., Wang Z.X., Huang P., Tong X.J., Zhang B., and Lin S., 2011, Progress in zinc finger nuclease engineering for targeted genome modification, Yichuan (Hereditas), 33(7): 665-683 (肖安, 胡莹莹, 王唯晔, 杨志芃, 王展翔, 黄鹏, 佟向军, 张博, 林硕, 2011, 人工锌指核酸酶介导的基因组定点修饰技术, 遗传, 33(7): 665-683)
Young T.E., DeMason D.A., and Close T.J., 1994, Cloning of an a-Amylase cDNA from Aleurone tissue of germinating maize seed, Plant physiology, 105: 759-760
Yuan L.P., 1966, A preliminary report on maale sterility in rice, Oryza sativa L., Kexue Tongbao (Chinese Science Bulletin), 17(4): 322 (袁隆平, 1966, 水稻的雄性不孕性.科学通报, 4:185-188)
Yuan L.P., 1990, Progress of two-line system hybrid rice breeding, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 23(3): 1-6 (袁隆平, 1990, 两系法水稻研究的进展, 中国农业科学, 23(3): 1-6)
Zhang K.T. and Fu H.Y., 1982, Effect of high temperature on fertility of the male sterile lines in Sorghum, Yichuan Xuebao (Acta Genetica Sinica), 9(1): 71-77 (张孔湉, 傅鸿仪, 1982, 高温处理对高粱雄性不育系育性的影响, 遗传学报, 01: 71-77)
Zhang T.Z., 1995, A discussion on the inheritance of Dong-A genetic male sterility and its fertility maintaining line (MB) in upland cotton, Yichuan (Hereditas), 17(6): 30-33 (张天真, 1995, 陆地棉洞A核雄性不育系及其MB保持系的遗传模式讨论, 遗传, 17(06): 30-33)
Zhang Y.Y., Zhang X.H., and Zhang C.J., 2008, Targeted gene mutagenesis and replacement mediated by zinc finger nucleases, China Biotechnology, 28(11): 110-115 (张余洋, 张晓辉, 张婵娟, 2008, 利用人工锌指蛋白核酸酶进行植物基因定点突变和置换, 中国生物工程杂志, 28(11): 110-115)
Zhou H.S., 1996, The history and present condition of nuclear male sterile research in maize and a new method-yellow green seedling system, Yumi Kexue (Maize Science), 4(1): 7-8 (周洪生, 1996, 玉米核不育利用的历史、现状及其新途径—黄绿苗标记法, 玉米科学, 4(1): 7-8)
.png)
.png)
.png)