 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 5 篇 doi: 10.5376/mpb.cn.2012.10.0005
收稿日期: 2012年02月08日 接受日期: 2012年02月21日 发表日期: 2012年03月07日
引用格式(中文):
李晓斐等, 2012, 栽培种花生乙酰ACP硫酯酶基因(AhfatB)克隆及表达载体构建, 分子植物育种(online) Vol.10 No.5 pp.1032-1037 (doi: 10.5376/mpb. cn.2012.10.0005)
引用格式(英文):
Li X.F., et al., 2012, Cloning of AhfatB encoding Acyl-ACP thioesterase in Peanut (Arachis hypogaea L.) and constructing its expression vector, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.5 pp.1032-1037 (doi: 10.5376/mpb.cn.2012.10.0005)
本研究以花生栽培品种山花7号叶片DNA为模板进行PCR扩增,克隆获得花生乙酰ACP硫酯酶基因(AhfatB) DNA序列,序列全长2 720 bp,编码区位于124 bp~2 341 bp,开放阅读框全长1 242 bp,编码413个氨基酸,基因内存在3个内含子分别位于607~754 bp、 878~1 495 bp和1 607~1 828 bp。提取花生幼果RNA,经RT-PCR扩增,得到AhfatB基因的全长cDNA,将其与PBI121表达载体35S启动子连接,替换其中的GUS基因,构建了植物表达载体PBI121-AhfatB。
植物体中脂肪酸的合成主要发生在质体中,乙酰辅酶A催化第一步反应,随后在脂肪酸合成酶(fatty acid syntheses, FAS)的催化作用下进行碳链的延长,酰基载体蛋白(acyl-carried proteins, ACP)与生成的碳链结合,保护新生成的碳链免受其他多种酶的侵蚀。以每次反应增加两个碳的方向合成酰基碳链,最后在酰基-ACP硫酯酶(acyl-ACP thioesterase, FAT)的作用下分离得到游离脂肪酸和载体蛋白ACP (Dehesh et al.,1996)。
植物中编码酰基-ACP硫酯酶(FAT)的基因通常分为fatA和fatB两类(元冬娟等, 2009)。fatA主要编码18:1-ACP硫酯酶,18:1-ACP硫酯酶是一类重要的“持家”酶类,在大多数植物中,FatA具有很强的18:1-ACP催化活性(Aubrey et al., 1995)。fatB主要编码生成饱和脂酰碳链的硫酯酶,也有一部分编码生成非饱和脂酰碳链的硫酯酶。在大多数植物中,FatB是一类具有16:0-ACP特性的硫酯酶,催化C16:0的生成(Dormann et al., 1994)。在榆树、椰子和棕榈等富含中链脂肪酸的植物中,8:0-ACP、10:0-ACP、12:0-ACP硫酯酶和14:0-ACP硫酯酶(Salas and Ohlrogge, 2002)大量存在。
花生是重要的油料作物,花生中脂肪酸的合成是由一系列位于质体和线粒体的脂肪酸合成酶催化完成的(Voelker and Kinney, 2001; Mekhedov and Ohlrogge, 2000)。花生种子脂肪酸合成的最后一步,在酰基ACP硫酯酶的催化作用下,生成游离的脂肪酸和酰基载体蛋白ACP。酰基ACP硫酯酶具有链的长度特异性(Ghosh et al., 2007),所以它的活性影响着花生脂肪酸合成产物中各种脂肪酸之间的比率。
本文采用PCR扩增技术克隆得到了花生中乙酰ACP硫酯酶基因(AhfatB)全长DNA序列,比较了AhfatB序列与蓖麻、向日葵等其他作物中该基因序列的同源性,并将克隆片段与PBI121表达载体35S启动子连接,构建PBI121-AhfatB表达载体。为进一步研究AhfatB的特性及进行基因转化提供了理论依据及准备材料。
1 结果与分析
1.1 AhfatB全长DNA序列的克隆
以山花7号叶片DNA为模板,用引物AhfatB-1/AhfatB-2进行PCR扩增。扩增产物经电泳检测,片段长度大于目的片段1 486 bp (图1)。推测基因内有内含子存在。
.png) 图1 花生AhfatB基因PCR产物电泳图 注: M: DNA marker DL2000; 1~ 5: PCR产物 Figure 1 Electrophoresis of PCR products of AhfatB of Peanut (Arachis hypogaea L.) Note: M: DNA marker DL2000; 1~5: PCR product |
以花生叶片DNA为模板,用引物AhfatB-3/ AhfatB-4进行PCR扩增。PCR扩增产物电泳检测,片段长度与目的片段长度739 bp大小相符(图2),推测此片段内无内含子存在。
.png) 图2 花生AhfatB基因PCR产物电泳图 注: M: DNA marker DL2000; 1: PCR产物 Figure 2 Electrophoresis of PCR products of AhfatB of Peanut (Arachis hypogaea L.) Note: M: DNA marker DL2000; 1: PCR product |
继续在其他片段设计引物,拼接得到花生中AhfatB基因全长DNA序列(图3)。序列全长2 720 bp,编码区位于124 bp~2 341 bp,开放阅读框全长1 242 bp,基因内存在3个内含子。
 图3 花生中AhfatB基因DNA全序列 注: 黑色阴影: 起始密码子和终止密码子; 灰色阴影: 外显子; 白色区域: 内含子 Figure 3 The full-length DNA sequence of AhfatB of Peanut (Arachis hypogaea L.) Note: The black shadow: Initiator codon and terminator codon; The gray shadow: Extron; The white sector: Intron |
1.2 花生AhfatB基因cDNA克隆及同源分析
采用TRIzol法提取山花7号幼果的总RNA,以反转录cDNA第一条链作为模板,用引物AhfatB-1/AhfatB-2进行PCR扩增。扩增产物经1%的琼脂糖凝胶电泳后,得到一条1 700 bp左右与预期大小相符的特异性条带(图4)。回收目的片段与pEASY-T1载体连接,转化大肠杆菌,挑选两个阳性克隆送上海生工科技有限公司测序,测序结果(图5)显示,克隆片段长1 486 bp,与GenBank中公布的花生中的AhfatB基因序列同源性为99.51%,确定克隆到的序列是试验需要的目的片段。
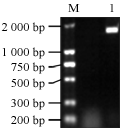 图4 花生AhfatB基因RT-PCR电泳结果 注: M: DNA marker DL2000; 1: PCR产物 Figure 4 Electrophoresis o f RT-PCR products of AhfatB of Peanut (Arachis hypogaea L.) Note: M: DNA marker DL2000; 1: PCR product |
 图5 花生中AhfatB基因测序后所得序列 Figure 5 Sequence of AhfatB of Peanut (Arachis hypogaea L.) after sequencing |
目的基因片段碱基序列与蓖麻、向日葵、澳大利亚坚果、拟南芥进行同源性比较,同源性分别为51.67%、63.26%、61.78%、65.43% (图6)。可见AhfatB基因在不同作物中有较高的保守性,也说明我们得到的目的基因片段较准确,可以用于表达载体的构建。
 图6 五种不同作物中AhfatB cDNA序列的同源性比较 Figure 6 Homology analysis for cDNA sequence of AhfatB from five crops |
1.3 AhfatB植物表达载体的构建
RT-PCR扩增获得的AhfatB cDNA序列经1%的琼脂糖凝胶电泳回收后,与克隆载体pEASY-T1连接,命名为pEASY-AhfatB,提取质粒DNA,进行检测,将连接后的载体pEASY-AhfatB用BamHI和SacI双酶切,酶切结果如图7所示。由图7可见,通过双酶切分别得到一条长片段的的载体和一条与目的片段大小相同的条带。用BamHI和SacI同样酶切载体PBI121,回收PBI121的大片段和pEASY- AhfatB的小片段进行连接,重组子命名为PBI121-AhfatB。将重组子转化大肠杆菌,用50 mg/L kan筛选重组子,挑取抗Kan的单菌落,进行菌落PCR鉴定。菌液PCR (图8)和酶切鉴定电泳图谱(图9)中均出现约1500bp左右的目的条带,说明克隆的AhfatB基因片段已经连接到PBI121载体上替换了GUS基因,从而构建了花生基因AhfatB表达载体。
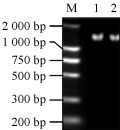 图7 BamHI和SacI酶切重组子pEASY-AhfatB电泳图谱 注: M: DNA marker DL2000; 1~2: 双酶切产物 Figure 7 Electrophoresis of the recombinant PEASY-AhfatB, Restriction enzyme digestion with BamHI and SacI Note: M: DNA marker DL2000; 1~2: Recombinant cloned vector digested product |
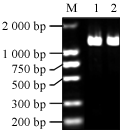 图8 重组子PBI121-AhfatB的菌液电泳图谱 注: M: DNA marker DL2000; 1~2: 菌液PCR产物 Figure 8 Electrophoresis of recombinant PBI121-AhfatB bacteria liquid Note: M: DNA marker DL2000; 1~2: PCR product of bacteria liquid |
 图9 重组子PBI121-AhfatB的BamHI和SacI双酶切鉴定 注: M: DNA marker DL15000; 1: 酶切产物 Figure 9 Identification of the recombinant PBI121-AhfatB restriction enzyme digestion with BamHI and SacI Note: M: DNA marker DL15000; 1: Product of digesting recombinant cloned vector |
2讨论
随着工业生产以及人类对植物食用油持续性增长的需求,人类对植物油脂的需求越来越多样化,原来的植物油脂种类已不能满足现代人的生活、生产需求。因此,开发植物油脂种类的多样化已成为植物脂肪酸合成代谢工程研究的焦点问题。酰基ACP硫酯酶是催化脂肪酸合成的关键酶之一,具有链的长度的特异性,不同的硫酯酶催化生成不同碳链长度的脂肪酸。花生中16碳或18碳脂肪酸酰基ACP硫酯酶大量存在,其大部分脂肪酸为16碳或18碳脂肪酸(Dehesh et al., 1996),但在工业生产中,碳链长度介于6和24碳之间的脂肪酸,具有重要的用途(Davies et al. , 1991)。通过基因工程技术,如能使中长链脂肪酸酰基ACP硫酯酶在花生中过量表达,改变花生种子中脂肪酸组分,从而为工业生产及人类生活做出贡献。
为了进一步分析花生中乙酰ACP硫酯酶基因以及从转基因方面研究该基因的特性,本研究中我们通过克隆得到了花生AhfatB全长DNA序列、并分析了花生中AhfatB序列与其他作物中该基因序列的同源性,有助于我们进一步研究该基因的起源及同源特性。通过替换载体PBI121上的GUS基因,构建了表达载体PBI121-AhfatB,为下一步进行基因转化做好前期准备。
综上所述,从基因角度来进行花生品种的改良,还需要我们进行大量的基因方面的研究以及转基因方面的工作,本研究只是构建好了植物表达载体,但对于AhfatB转入受体植物后会有怎样的效果,还需要进一步工作及研究。
3 材料和方法
3.1材料
花生(Arachis hypogaea L.) 栽培品种山花7号,由山东农业大学花生研究所提供。
植物总RNA提取剂、TapDNA聚合酶、反转录试剂盒、克隆载体pEASY-T1均购自TransGen Biontech;T4DNA连接酶、限制性内切酶BamHI和SacI购自宝生物科技有限公司;DNA回收试剂盒和质粒提取试剂盒购自天根生化科技有限公司;表达载体质粒pBI121 由山东农业大学生命科学学院郑成超教授惠赠;引物合成由上海生工生物服务公司完成;目的片段测序由华大基因科技公司完成。
3.2引物合成
根据GenBank公布的花生中的AhfatB序列(登录号:EF117305),设计4条引物AhfatB-1:5′-CG GGATCC CGTCGTCTTCTGCTTACT-3′(下划线处为BamHI酶切位点)、AhfatB-2:5′- GC GAGCTC CTACTTTCCCCACCTT AC-3′(下划线处为SacI酶切位点)、AhfatB-3:5′- TCCCTGTTCCTTCACC T-3′、 AhfatB-4: 5′- AGCCTCCTTGTT AGT TT ATTCA-3′引物由上海生工生物工程技术服务有限公司合成。
3.3 AhfatB全长DNA序列的克隆
提取花生叶片中的DNA, 以此为模板,用引物AhfatB-1/AhfatB-2进行PCR扩增。在20 μL反应体系中加入:10倍Tap Buffer 2 μL,2.5×10-3 mol/L dNTP 1.6 μL,TapDNA聚合酶0.2 μL,引物AhfatB-1 (10-5 mol/L) 0.5 μL,AhfatB-2 (10-5 mol/L) 0.5 μL,ddH2O 0.5 μL。PCR反应条件:95℃预变性1 min;95℃变性1 min,62℃退火1 min,72℃延伸1 min,30个循环;72℃后延伸10 min。
3.4乙酰ACP硫酯酶基因cDNA的克隆及同源分析
用TRIzol法提取花生幼果中的RNA,用TransGen RNA PCR kit试剂盒进行反转录,以合成的第一链cDNA为模板,进行RT-PCR扩增。扩增体系及PCR反应条件同3.3。
将花生中的AhfatB序列与蓖麻、拟南芥和向日葵中的序列进行同源比较,分析他们的同源性。
3.5乙酰ACP硫酯酶基因植物表达载体的构建
以反转录cDNA第一条链作为模板进行PCR扩增。反应体系及PCR反应条件同3.3。PCR反应后,用1%琼脂糖电泳分离目的片段,回收目的片段。将回收的目的片段和克隆载体pEASY-T1连接,转化大肠杆菌DH5α,蓝白斑筛选阳性克隆,挑取白色克隆做PCR鉴定,挑选正确的阳性克隆测序。
将测序结果与GenBank公布的序列进行序列比对,选用测序结果正确的样本用试剂盒提取质粒DNA,以此为模板,进行PCR鉴定。将克隆载体PBI121和重组载体pEASY- AhfatB分别用限制性内切酶BamHI、SacI双酶切,回收PBI121的大片段和pEASY- AhfatB的小片段进行连接(图10),将重组质粒转化大肠杆菌,用50mg/L kan筛选重组质粒,挑取抗Kan的单菌落,进行菌落PCR鉴定。
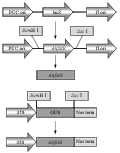 图10 表达载体PBI121-AhfatB构建连接流程图 注: lacZ: β-半乳糖苷酶基因Z; 35S: 花椰菜花叶病毒35S启动子; Nos term: 终止子; pUC ori/fl ori: 质粒复制起始位置; GUS: β-葡萄苷酸酶; AhfatB: 花生乙酰ACP硫酯酶基因 Figure 10 Construction process of expression vector PBI121-AhfatB Note: lacZ: β-galactosidase gene Z; 35S: Cauliflower mosaic virus 35S promoter; Nos term: Terminator; pUC ori/fl ori: Element for plasmid DNA replication; GUS: β-glucuronidase; AhfatB: acyl-ACP thioesterase gene |
作者贡献
李晓斐是本研究的实验设计和实验研究的执行人并完成数据分析,论文初稿的写作;万勇善、刘风珍是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由山东省花生良种产业化工程项目、国家公益性行业科研专项(Nyhyzx07-14)和国家863计划项目(2006AA100106)共同资助。
参考文献
Davies H.M., Anderson L., Fan C., and Deborah J.H., 1991, Developmental induction, purification,and futher characterization of 12:0-ACP thioesterase from immature cotyledons of Umbellularia californica. Archives of Biochemistry and Biophysics, 290(1):37-45
http://dx.doi.org/10.1016/0003-9861(91)90588-A
Dehesh K., Edwards P., Hayes T., Cranmer A.M., and Fillatti J., 1996, Two novel thioesterases are key determinants of the bimodal distribution of acyl chain length of Cuphea palustris seed oil, Plant Physiol, 10(1):203-210
http://dx.doi.org/10.1104/pp.110.1.203
PMid:8587983 PMCid:157710
Dormann P., Kridl J.C., and Ohlrogge J.B., 1994, Cloning and expression in Escherichia coli of a Cdna coding for the oleoyl-acyl carrier protein thioesterase from coriander (Coriandrum sativum L), Biochim Biophys Acta, 1212(1):134-136
Ghosh S.K., Bhattacharjee A., Jha J.K., Mondal A.K., Maiti M.K., Basu A., Ghosh D., Ghosh S., and Sen S.K., 2007, Characterization and cloning of a stearoyl/oleoyl specific fatty acyl-acyl carrier protein thioesterase from the seeds of Madhuca longifolia, Plant Physiol Biochem, 45(12):887-97
http://dx.doi.org/10.1016/j.plaphy.2007.09.003
Jones A., Davies H.M., and Voelker T.A., 1995, Palmitoyl-Acyl carrier protein (ACP) Thioesterase and the evolutionary origin of plant acyl-ACP thioesterases, American Society of Plant Physiologists,7: 359-371
Mayer K.M., and Shanklin J., 2007, Identification of amino acid residues involved in substrate specificity of plant acyl-ACP thioest- erases using a bioinformatics-guided approach, BMC Plant Biology, 7:1
http://dx.doi.org/10.1186/1471-2229-7-1
Mekhedov S., and Ohlrogge J., 2000, Toward a functional catalog of the plant genome.A survey of genes for lipid biosynthesis, Plant Physiol, 122:389-402
http://dx.doi.org/10.1104/pp.122.2.389
Salas J.J., and Ohlrogge J.B., 2002, Characterization of substrate specificity of plant FatA and FatB acyl-ACP thioesterases, Arch Biochem Biophys, 403:25-34
http://dx.doi.org/10.1016/S0003-9861(02)00017-6
Voelker T., and Kinney A.J., 2001, Variations in the biosynthesis of seed-storage lipids, Annu Rev Plant Physiol, 52:335-361
http://dx.doi.org/10.1146/annurev.arplant.52.1.335
Yuan D.J., Wu P., and Jiang L.M.,2009, Recent development of Acyl-ACP thioesterase research in higher plant, Zhongguo Youliao Zuowu Xuebao (Chinese Journal of Oil Crop Sciences), 31(1):103-108 (元冬娟,吴湃,江黎明,高等植物的酰基ACP硫酯酶研究进展,中国油料作物学报, 2009, 31(1): 103-108