 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2015 年, 第 13 卷, 第 10 篇
收稿日期: 2015年05月19日 接受日期: 2015年09月11日 发表日期: 2006年04月11日
引用格式(中文):
张原宇等, 2015, 叶酸生物合成途径中调控基因folB表达载体的构建及在大豆中的转化, 分子植物育种(online), 13(10): ?-? (doi: 10.5376/mpb.cn.2015.13.0010)
引用格式(英文):
Zhang et al., 2015, Construction of the Folate Biosynthetic Pathway Regulatory Gene folB and Transformation of Soybean, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 13(10): ?-? (doi: 10.5376/mpb.cn.2015.13.0010)
叶酸是一种水溶性B族维生素,是维持人体正常活动所必需的营养元素之一,也是植物体内参与一碳单元反应的重要辅酶。folB基因是叶酸调控基因,来源于拟南芥,调控叶酸合成途径中的关键酶DHNA的生成。本研究将人工合成的folB基因转入大豆受体材料Williams82中。共侵染200个大豆外植体,得到26株转化苗。通过对转化苗的草丁膦(浓度150 mg/L)涂抹鉴定,获得16株除草剂抗性转化苗。通过PCR检测,得到12株PCR阳性转化苗。经过bar试纸条检测,其中10株为阳性。Southern杂交结果表明,9株转化苗为Southern杂交阳性。研究结果表明:外源功能基因folB和筛选标记基因bar已经整合到大豆基因组中。相应的转基因后代表现出除草剂抗性和folB基因Southern杂交阳性。本研究通过将folB基因转入大豆,获得了转基因后代,以此为基础可进一步选育高叶酸含量的转基因大豆品种。
叶酸(Folate)是一类生化特征相近,化学结构相似的化合物统称,是一种水溶性B族维生素,又称维生素M、维生素Bc或蝶酰谷氨酸,由蝶啶、对氨基苯甲酸和1个或多个谷氨酸结合而成(图1) (Hao et al., 1999; Li et al., 2012)。
叶酸是维持生物体正常生命过程所必需的一类有机物质,是大多数生物体内一碳单元的供体,是参与核酸、氨基酸等生物代谢所必需的元素(Wang et al., 2000)。人类和其他动物不能自身合成叶酸(Cossins and Chen, 1997; Rébeillé and Douce, 1999),需要通过植物这种饮食来源来摄取(de Bree et al., 1997)。成年人每天应摄取至少200 μg叶酸,孕妇和乳母为400 μg叶酸(Scott et al., 2000)。人体缺乏叶酸时,会导致贫血、神经系统疾病,心血管病以及癌症等发病率也会显著增加(Hossain et al., 2004)。叶酸量摄取不足是一个全球化的健康问题(Bekaert et al., 2007)。发达国家通过在食品中添加人工合成的叶酸来改善人们的叶酸供给水平,但过量的摄入叶酸也会引起一些不良的反应,并间接的促进肿瘤的生长(Scott et al., 2000)。通过食用蔬菜,豆类等,补充叶酸是十分安全有效的方式。近几十年,随着生物技术的日益发展,广大科研工作者成功将参与叶酸代谢合成的一些基因通过生物技术手段对主要农作物进行叶酸强化育种工作,在当代育种工作中受到广泛关注。
Dihydroneopterin (DHN)醛缩酶是参与调控叶酸合成的一种酶,这种酶催化7, 8-dihydroneopterin (DHN),转换为6-羟甲基-7, 8-二氢喋呤酸化酶,由folB基因在大肠杆菌中编码。folB已经在多种细菌和卡氏肺囊虫中克隆鉴定,在肺炎链球菌中folB是调控蛋白,具有DHNA和二羟甲基二氢喋呤焦磷酸酶的作用。而在卡氏肺囊虫中的folB为三功能蛋白酶,除具备DHNA和二羟甲基二氢喋呤焦磷酸酶功能外,还具有二氢喋酸合酶的活性(Goyer et al., 2004; Dittrich et al., 2008)。Goyer等首先对植物中的folB蛋白进行了报道(Goyer et al., 2004)。拟南芥中克隆得到3个与folB同源的基因序列,编号为AtfolB1-3。番茄中也得到一种与folB类似的蛋白LefolB。Goyer等在大肠杆菌中过表达了AtfolB1-3和LefolB1,除AtfolB3没有以活性形式表达外,其他3种蛋白都具有DHNA活性。
豆类作物,本身叶酸含量较高,但受到储存方式,食品加工方式等客观因素影响,最终提供给人体利用的叶酸却很少。本研究采用拟南芥来源的叶酸合成途径调控基因folB,构建在植物表达载体中,并通过转基因技术将叶酸调控基因folB整合到大豆基因组中,旨在生产出高叶酸含量的大豆品种,以满足人们对叶酸日益增长的需求。
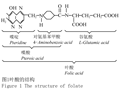 图1 叶酸的结构 Figure 1 The structure of folate |
1结果与分析
1.1目的基因的克隆
以人工合成的folB基因为模板,以folB-FR为引物,在左右引物中分别引入BamHI和SacI酶切位点,通过PCR扩增得到folB基因全长441 bp,然后克隆到pTF101-35S载体中(图2A),构建好的质粒经过测序和酶切检测(图2B)正确后转入农杆菌EHA101中,用于大豆遗传转化。
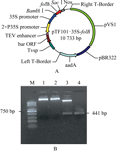 图2 folB基因质粒载体图谱及电泳检测 注: A为pTF101-35S-folB载体图谱; B为载体酶切电泳检测图, 其中M: Trans2KTM Plus DNA Marker; 1: pTF101-35S空载体; 2: 未经酶切的pTF101-35S-folB载体; 3: 经BamHI和SacI双酶切的pTF101-35S-folB载体; 4: folB编码区全长片段 Figure 2 The map of plasmids vector pTF101-35s-folB and electrophoresis detection Note: A is the map of pTF101-35s-folB; B is the result of electrophoresis detection; M: Trans2KTM Plus DNA Marker; 1: Plasmid pTF101-35s; 2: Plasmid pTF101-35s-folB; 3: Digested; 4: Full-length folB |
1.2大豆子叶节的遗传转化
将带有基因folB的表达载体,通过液氮冻融法转化在农杆菌菌株EHA101中,通过农杆菌介导的大豆子叶节遗传转化法,对大豆受体品种Williams82进行转化(图3)。共切取200个大豆外植体,经过继代筛选,生根成苗,最终得到T0代转基因再生植株26株,转化率接近13%。
 图3农杆菌介导的大豆子叶节遗传转化法 注: A: 灭菌后的种子放入萌发培养基中发芽; B: 切开的子叶节, 放入工程菌液中侵染; C: 侵染后的子叶节放入共培养基中培养; D: 子叶节在分化培养基中, 长出丛生苗; E: 丛生苗在伸长培养基中, 伸长成转化苗; F: 将伸长至少4 cm的转化苗切下, 在生根培养基中生根; G: 生根的转化苗, 经炼苗后, 移栽温室管理 Figure 3 Agrobacterium-mediated soybean transformation using the cotyledonary node as explants Note: A: Sterile seeds germination; B: Explants were inoculated with Agrobacterium tumefaciens; C: Explants were inoculated with co-cultivated in co-cultivation medium; D: .Explants were embedded into solid shoot induction medium; E: .Explants were embedded into shoot elongation medium; F: .After shoot elongated to at least 4 cm in length, they placed in rooting medium; G: Rooted shoots were directly transferred to a greenhouse and grown to maturity |
1.3转基因阳性植株筛选鉴定
转化苗通过草丁膦涂抹鉴定得到15株表现除草剂抗性的转化苗(图4),通过PCR检测目的基因folB,检测出12株呈阳性的T0代转基因植株(图5)。通过Southern杂交方法对得到的12株PCR呈阳性的转基因植株进行了拷贝数的分析。经过bar试纸条检测得到10株(图6)试纸条阳性转化苗。Southern杂交结果表明,在10个转基因植物中得到9个株系为folB全长cDNA插入到基因组中(图7)。经过内切酶EcoRI酶切,转基因植株4~12有杂交带出现,3号和13号没有杂交带出现,而3号为非转基因植株对照。这说明目的基因已经整合到植物基因组中。13号转基因植株在图4中没有条带,说明是假阳性,目的基因并没有真正的整合到植物基因组中。杂交带大小有所不同,说明外源基因整合位点不同。
 图4 T0代转基因阳性植株的草丁膦抗性分析 Figure 4 BASTA resistance of T0 transgenic plants |
 图5 T0代转化植株的PCR法鉴定转基因苗, 上排为目的基因检测结果, 下排为相应单株DNA用GmActin引物检测的结果 注: M: Trans2KTM Plus DNA Marker; “+”: 质粒阳性对照; “-”:阴性对照; 1~15: 依次为经过除草剂涂抹法筛选的T0代转基因材料 Figure 5 PCR analysis of the transgenic plants, one is for folB, and the other is Actin Note: M: DNA Marker (Trans2KTM Plus DNA Marker); "+": Plasmid;"-": The negative control; 1~15: The transgenic plants from T0 lines after BASTA |
 图6 bar基因试纸条检测 Figure 6 Strip the identification of the bar gene |
 图7 转基因T0植株的Southern blot杂交, EcoRI酶切 注: 1: 分子量Marker Trans15K; 2: 质粒DNA; 3: 阴性对照; 4~13: 经过PCR检测的转基因植株 Figure 7 Southern blot analysis of T0 transgenic plants, digested by EcoRI Note: 1: Marker Trans15K; 2: Plasmid; 3: The negative control; 4~13: Transgenic plants from T0 after PCR |
2讨论
随着转基因技术的发展,转基因辅助育种成为现代育种工程重要手段之一。大豆子叶节遗传转化法是比较快捷的,从切子叶节到得到阳性苗,仅需4个月左右的时间就能完成。但转化苗存在一定数量的嵌合体和高拷贝数,这一点对日后的育种工作不利。转化苗的阳性率和外源基因的整合性与转化过程中所用的表达载体,受体基因型,农杆菌毒性等因素有关。Olhoft等研究表明培养基中适当添加银离子可以增加外源基因的插入效率和获得更多的单拷贝植株(Olhoft et al., 2004)。本研究的生苗率接近13%,阳性率为4.5%,阳性率较低,因此如何提高大豆转基因阳性率和单拷贝数量,是有待解决的问题。
提高植物体内叶酸的含量主要有三种方式:第一种是通过合成途径的限速酶来改造合成途径;第二种是减少叶酸的分解;第三种是提高叶酸的稳定性。三种方式可以共同协作,也可单独加强。当叶酸与其依赖蛋白结合时,稳定性大大提高。因此过量表达叶酸依赖蛋白或调控蛋白,有可能提高叶酸的含量。在本研究中我们已将高叶酸folB调控基因成功导入到大豆受体材料中, 并且获得了Southern杂交阳性的转基因株系,但对叶酸含量还未进行测定。在后期工作中将对初世代材料加代繁殖,测定材料中的不同组织内的叶酸含量。
3材料与方法
3.1受体材料
受体材料为大豆品种Williams82,由农业生物技术研究所转基因大豆课题组提供。
3.2菌种和质粒
大肠杆菌菌株为E.coli Trans10,农杆菌菌株为EHA101,植物表达载体pTF101-35s,高叶酸调控基因folB均由农业生物技术研究所大豆课题提供。
3.3生物试剂
聚合酶2×Easy Tag PCR SuperMix购自北京全式金公司;限制性内切酶、T4-DNA连接酶等生物酶试剂购自NEB试剂公司;胶回收DNA小片段试剂盒购自爱思进试剂生物公司;Southern杂交试剂盒购自罗氏试剂公司,其他生化试剂均为国产分析纯产品。
3.4植物表达载体的构建
根据NCBI上大肠杆菌folB基因(基因编号; BT030075)序列,按照密码子偏爱性,人工合成folB基因。在folB基因上游引入内切酶BamHI酶切位点,下游引入内切酶SacI酶切位点。通过DNA胶回收试剂盒回收PCR产物,把folB基因片段经BamHI和SacI酶切后连接在pTF101-35s载体上形成pTF101-35s-folB。同时针对folB基因,利用Primer Premier 5.0软件设计PCR分子检测扩增特异性引物如下:folB-F: 5'-TAGAAACAGAGGATCC-ATGCATAGCTCACTGGAGACCAC-3' folB-R: 5'-GATCGGGGAAATTCGAG
CTC-TCAGTTCTTTGAACTAGTGTTTCGC-3'。
3.5农杆菌介导的大豆遗传转化
以农杆菌株EHA101作为工程菌株,将pTF101-35s-folB通过大豆子叶节方法转入大豆受体材料Willimas82中。农杆菌介导大豆子叶节转化法基本流程如下:(1)菌液制备:农杆菌28℃培养16 h后收集单克隆菌体,转入YEP液体培养基中,放入摇床28℃,180 rpm培养12 h左右至菌液OD600值0.5~0.7备用。(2)受体准备:选取大豆受体品种Williams82成熟无破损的种子,氯气灭菌16 h。灭菌后种子放入萌发培养基(Olhoft et al., 2003)弱光萌发16 h。(3)子叶节法:切子叶节,从胚轴处将大豆种子一分为二,切时刀尖蘸工程菌液,用手术刀轻刮下胚轴,制造小创口。将切开后的子叶节放入工程菌液中,轻柔晃动30 min后转入共培养基中,避光培养(23℃, 3~5 d)。(4)共培养后,将伸长的胚轴切去约3/4,保留约5 mm的胚轴,插入加筛选剂的分生培养基中,诱导丛生芽生长,培养条件25℃,光照16 h/d,光照强度2 000 lx。(5)在分生培养基中培养7 d后,转入筛选培养基中,间隔15 d继代1次,筛选3~4轮,得到伸长生长的分生苗。(6)将已经伸长的分生苗从外置体上切下,转入生根培养基中生根,生根10 d左右,得到转化苗。(7)生根健全的转化苗,经炼苗(3~5 d)后移入盆中栽培,温室正常管理。
3.6转基因植株的草丁膦抗性检测
植物表达载体以bar (草丁膦)作为筛选标记,因此在转基因后代中可采用草丁膦涂抹叶片的方法快速检测转基因苗。具体方法:选取健康叶片,用棉签蘸取适量草丁膦(浓度为150 mg/L)溶液,轻柔涂抹转化苗半片叶子,并做好标记,同叶未涂抹的叶子作为对照,在自然光照情况下3~6 d后观察叶片生长和变色情况。
3.7转基因植株T0代的PCR检测
利用folB基因引物对T0代转基因植株基因组DNA进行PCR检测。使用CTAB法提取T0代转化植株及对照Willimas82的DNA。PCR反应体系(25 µL):DNA模板100 ng,2×Easy Tag PCR SuperMix 12.5 µL,10 µmol/L引物各0.5 µL,加ddH2O补至25 µL。PCR反应程序:94℃,预变性5 min,94℃,变性30 s,55℃退火30 s,72℃延伸1 min,30个循环,72℃延伸5 min。PCR扩增产物通过1%琼脂糖凝胶电泳分离,并拍照和分析。
3.8 bar试纸条检测
取少量嫩绿叶子(约小指甲大小)放入1.5 mL的离心管中,加入200 µL提取缓冲液,用研磨棒捣碎混匀,将试纸条按箭头方向插入混合液中,静止5 min后观察结果。若试纸条出现2条带表明该植株是bar阳性植株,若出现1条带说明是bar阴性植株,如果没有条带说明操作有误或提取缓冲液不对。
3.9 T0代植株的Southern分析
为了检测folB全长基因是否插入到大豆基因组全长中及相对应的拷贝数, 选取bar试纸条检测呈阳性的10个T0代植株,进行基因组DNA的Southern blot分析。Southern blot分析使用的是Roche地高辛试剂盒KitⅡ型,实验具体流程参照Roche Southern blot KitⅡ型试剂盒说明书。以克隆到载体上的folB基因的全长作为Southern杂交探针,使用EcoRI内切酶进行基因组DNA酶切。
作者贡献
张原宇和张玲是本研究的实验设计和实验研究的执行人,完成论文初稿的写作;王玉民和邢国杰参与实验设计及论文修改;邢彬参与材料种植和数据整理;李海云是项目的构思及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家高技术研究发展计划“863计划”(2012AA101106-3)、吉林省2012年度博士后科研项目(20120010407)和转基因生物新品种培育重大专项(2014ZX08004)共同资助。
参考文献
Bekaert S., Storozhenko S., and Mehrshahi P., 2007, Folate biofortification in food plants, Trend in Plant Science, 13: 1360-1385
Cossins E.A., and Chen L., 1997, Folates and one-carbon metabolism in plants and fungi, Phytochemistry, 45: 437-452
de Bree A., van Dusseldorp M., and Brouwer I.A., 1997, Folate intake in Europe: recommended, actual and desired intake, Eur J Clin Nutr, 51: 643-660
Dittrich S., Mitchell L., and Blagborough A.M., 2008, An atypical orthologue of 6-pyruvoyltetrahydropt erin synthase can provide the missing link in thefolate biosynthesis pathway of malaria parasites, Mol. Microbiol, 67(3): 609-618
Goyer A., Illarionova V., and Roje S., 2004, Folate biosynthesis in higherplants cDNA cloning, heterologous expression, and characterization of dihydroneopterin aldolases, Plant Physiol., 135: 103-111
Hossain T., Rosenberg I., and Selhub J., 2004, Enhancement of folates in plants through metabolic engineering, Proc. Natl. Acad. Sci., USA, 101: 5158-5163
Hao L., Tang Y., and Li Z., 1999, Research progress of folate detection method, Zhonghua Yufang Yixue Zazhi (Chinese Journal of Preventive Medicine), 33(3): 177-179 (郝玲, 唐仪, 李竹, 1999, 叶酸检测方法研究进展, 中华预防医学杂志, 33(3): 177-179)
Li S., Jiang L., Wang C.Y., and Zhang C.Y., 2012, Research Advances in the Functions of Plant Folates, Zhiwu Xuebao (Chinese of Bulletin Botany), 47(5): 525-533 (李莎, 姜凌, 王崇英, 张春义, 2012, 叶酸在植物体内功能的研究进展, 植物学报, 47(5): 525-533)
Olhoft P.M., Flangel L.E., and Donovan C.M., 2003, Efficient soybean transformation using hygromycin B selection in the cotyledonary-node method, Planta, 216(5): 723-735
Olhoft P.M., Flagel L.E., and Somers D.A., 2004, T-DNA locus structure in a large population of soybean plants transformed using the Agrobacteri um-mediated cotyledonary-node method, Plant Biotechnology Journal, 2: 289-300
Rébeillé F., and Douce R., 1999, Folate synthesis and compartmentation in higher plants, In NJ Kruger, SA Hill, RG Ratcliffe, eds, Regulation of Primary Metabolic Pathways in Plants, Kluwer, Dordrecht, The Nether-lands, 42: 53-99
Scott J., Rébeillé F., and Fletcher J., 2000, Folic acid and folates: the feasibility for nutritional enhancement in plant foods, Journal of the Science of Food and Agriculture, 80: 795-824
Wang J.B., Gu P., Zhang D.H., and Li D., 2000, The research progress in analysis methods of folate, Zhongguo Shipin Tianjiaji (China Food Additives), (3): 49-54 (汪锦邦, 顾鹏, 章德宏, 李东, 2000, 叶酸分析方法的研究进展, 中国食品添加剂, (3): 49-54)