 作者
作者  通讯作者
通讯作者
豆科基因组学与遗传学, 2013 年, 第 4 卷, 第 4 篇
收稿日期: 2013年04月18日 接受日期: 2013年04月18日 发表日期: 2013年04月18日
引用格式(中文):
杨晶, 张广臣, 2013, 菜豆ISSR-PCR体系的优化与验证, 分子植物育种, 11(4): 611-616
引用格式(英文):
Yang J, and Zhang G.C., 2013, Optimization of ISSR-PCR reaction system and its verification in common bean, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 11(4): 611-616
用试剂盒法提取菜豆(Phaseolus vulgaris L.)嫩叶的基因组DNA,并以此为模板对影响ISSR-PCR反应体系的Taq酶量、模板浓度、dNTP浓度、Mg2+浓度、引物浓度5个因素进行了优化。结果表明总体积为25 μL的菜豆ISSR-PCR反应最优体系为:45 ng模板DNA,1 U Taq酶,2 mmol/L Mg2+,0.6 μmol/L引物和0.1 mmol/L dNTP,在此基础上对循环次数进行优化,最终确定最佳循环次数为45次。利用该体系,选取引物823对8份材料进行扩增,验证了该体系的稳定性。本研究旨在建立菜豆ISSR反应的最优体系,为今后利用该分子标记技术进行有关菜豆种质及遗传方面的研究奠定技术基础。
菜豆(Phaseolus vulgaris L.)是世界上栽培面积最大的食用豆类(郑卓杰, 1997, 中国农业出版社, pp.222-249),在中国大部分省(市、区)均有栽培,是中国重要的食用蔬菜。中国较大的地理纬度跨度及多样化的生态环境造就了菜豆品种的多样性。以往主要是通过细胞学特征和表型性状研究菜豆品种资源的遗传多样性,随着分子生物学的发展,利用分子标记进行菜豆资源鉴定和分类、构建分子遗传图谱、基因定位和品种抗性鉴定方面已取得一定进展。目前应用的分子标记主要包括RAPD (Beebe et al., 2000; 栾非时和祖元刚, 2002; 孙晓丹, 2003),SSR (田甜等, 2012; 王坤等, 2009)和SCAR (古瑜等, 2011)标记,关于菜豆ISSR分子标记的研究报道很少。
ISSR (inter-simple sequence repeats)是用于扩增2个距离较近的相邻SSR位点间序列的一种DNA分子标记技术(Zietkiewicz et al., 1994)。其原理是同一ISSR引物序列同时与两个较近但方向相反的SSR重复序列互补结合,并扩增这2个SSR位点间的序列。ISSR分子标记的PCR产物可提供比RAPD、SSR和RFLP更为丰富的多态性,试验重复性好,现被广泛应用于植物的品种鉴定(Tantasawat et al., 2010)、遗传图谱构建(邱英雄等, 2002)、基因定位(赵国芳, 2003)和种质资源的遗传多样性分析(李红等, 2012)等方面的研究。本研究通过单因素设计研究最优的菜豆ISSR-PCR反应体系,为今后利用该分子标记技术进行有关菜豆种质及遗传方面的研究奠定技术基础。
1结果与分析
1.1 DNA浓度检测
提取的基因组DNA用1%的琼脂糖凝胶电泳检测,由图1可知,用试剂盒法所提取的DNA片段无拖尾现象且较整齐,可用于后期ISSR-PCR反应。用紫外分光光度计检测DNA浓度为126.1 ng/μL,OD260与OD280比值为1.89,可知RNA杂质很少。OD260与OD230比值为2.20,说明溶液中无盐和小分子杂质,所提取DNA质量较好,可用于ISSR扩增。
 图1 菜豆DNA电泳结果 注: 1~8: 表1所列菜豆品种 Figure 1 Electrophoresis result of DNA on common bean Note: 1~8: Varieties of common bean listed in the following table 1 |
1.2 ISSR-PCR反应中各影响因素的确定
1.2.1 ISSR-PCR反应中Taq酶用量的确定
Taq酶为反应的主要影响因素(吴小丽等, 2007),其用量及种类直接影响扩增反应是否成功。由图2可知,Taq酶为1.0 U时产生清晰稳定的扩增条带,当Taq酶量小于1.0 U时扩增产物量少,随着Taq酶量增加,扩增条带的亮度明显增加,但扩增条带有弥散和缺失现象,说明Taq酶量1.0 U已接近使用上限。所以在25 μL反应体系中,最佳Taq酶用量为1.0 U。
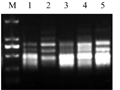 图2 Taq酶量对ISSR的影响 注: M: DL2000 marker; 1: 0.5 U; 2: 1.0 U; 3: 1.5 U; 4: 2.0 U; 5: 2.5 U Figure 2 Effect of Taq DNA polymerase concentration on ISSR amplification Note: M: DL2000 marker; 1: 0.5 U; 2: 1.0 U; 3: 1.5 U; 4: 2.0 U; 5: 2.5 U |
1.2.2 ISSR-PCR反应中模板用量的确定
ISSR-PCR反应对模板浓度适应范围较大,适宜的模板用量可保证扩增的特异性,浓度太低,无扩增产物或产物不稳定;浓度太高,则会相应增加非特异性扩增产物(冒维维等, 2006)。由图3可知,模板用量为25 ng、45 ng和55 ng时能产生清晰稳定的扩增条带,在65 ng时主条带不清晰,扩增产物减少,因此建议在菜豆ISSR-PCR反应体系中,模板用量取45 ng为宜。
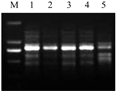 图3 DNA量对ISSR的影响 注: M: DL2000 marker; 1: 25 ng; 2: 35 ng; 3: 45 ng; 4: 55 ng; 5: 65 ng Figure 3 Effect of DNA concentration on ISSR amplification Note: M: DL2000 marker; 1: 25 ng; 2: 35 ng; 3: 45 ng; 4: 55 ng; 5: 65 ng |
1.2.3 ISSR-PCR反应中dNTP用量的确定
dNTP作为PCR反应的原料,浓度低则扩增产物少,影响效果,甚至会因dNTP消耗过早而导致产物单链化;浓度高会导致PCR错配,进而出现非特异性扩增。由图4可以看出,dNTP浓度在0.1~ 0.2 mmol/L之间时产生的条带较清晰且无拖尾现象,经比较,0.1 mmol/L的dNTP所扩增条带分辨率较高,当其浓度大于0.2 mmol/L时条带明显缺失,故dNTP浓度为0.1 mmol/L比较适合本反应体系。
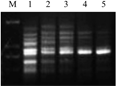 图4 dNTP量对ISSR的影响 注: M: DL2000 marker; 1: 0.10 mmol/L; 2: 0.15 mmol/L; 3: 0.20 mmol/L; 4: 0.25 mmol/L; 5: 0.30 mmol/L Figure 4 Effect of dNTP concentration on ISSR amplification Note: M: DL2000 marker; 1: 0.10 mmol/L; 2: 0.15 mmol/L; 3: 0.20 mmol/L; 4: 0.25 mmol/L; 5: 0.30 mmol/L |
1.2.4 ISSR-PCR反应中Mg2+用量的确定
Mg2+浓度直接影响Taq DNA聚合酶的活性,故其对PCR产率及扩增的特异性影响显著,Mg2+浓度过低会降低Taq酶的活性,使产率减少;浓度过高,则降低反应的特异性,进而导致非特异性扩增。如图5所示,Mg2+浓度在2 mmol/L时效果最佳。
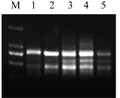 图5 Mg2+量对ISSR的影响 注: M: DL2000 marker; 1: 1.0 mmol/L; 2: 1.3 mmol/L; 3: 1.6 mmol/L; 4: 2.0 mmol/L; 5: 2.3 mmol/L Figure 5 Effect of Mg2+ concentration on ISSR amplification Note: M: DL2000 marker; 1: 1.0 mmol/L; 2: 1.3 mmol/L; 3: 1.6 mmol/L; 4: 2.0 mmol/L; 5: 2.3 mmol/L |
1.2.5 ISSR-PCR反应中引物用量的确定
引物用量也是ISSR-PCR扩增的重要影响因素。引物浓度太低,扩增条带弱,产物少;引物浓度太高,易导致碱基错配进而产生非特异性扩增,还会增加引物二聚体的形成(曾亮等, 2012)。由图6可知,引物浓度为0.6~0.7 μmol/L时可产生清晰稳定的扩增条带,当引物浓度在0.4 μmol/L时,条带较少且较弱。因此在能够保证条带清晰的条件下,选用较低的引物用量,即引物浓度为0.6 μmol/L为宜。
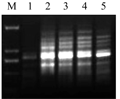 图6 引物浓度量对ISSR的影响 注: M: DL2000 marker; 1: 0.4 μmol/L; 2: 0.5 μmol/L; 3: 0.6 μmol/L; 4: 0.7 μmol/L; 5: 0.8 μmol/L Figure 6 Effect of primer concentration on ISSR amplification Note: M: DL2000 marker; 1: 0.4 μmol/L; 2: 0.5 μmol/L; 3: 0.6 μmol/L; 4: 0.7 μmol/L; 5: 0.8 μmol/L |
1.2.6 ISSR-PCR反应中循环次数的确定
ISSR-PCR产物的产量受循环次数的影响较大,循环次数多,会引起非特异性扩增;循环次数少,则产物量较低,条带相对较弱。本研究用引物823对最佳反应体系的菜豆进行DNA扩增,次数依次为35次,40次和45次。结果表明,45次循环时扩增条带亮度高,条带清晰,且未产生非特异性扩增现象;35次循环和40次循环扩增条带均较弱。因此45次循环为本体系最佳循环次数(图7)。
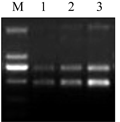 图7 循环次数对ISSR的影响 注: M: DL2000 marker; 1: 35 cycles; 2: 40 cycles; 3: 45 cycles Figure 7 Effect of cycles on ISSR amplification Note: M: DL2000 marker; 1: 35 cycles; 2: 40 cycles; 3: 45 cycles |
1.3对优化后菜豆ISSR-PCR体系的验证
通过以上的研究最终确立适合菜豆的ISSR反应体系(25 μL)为:模板DNA 45 ng,Taq酶1 U,Mg2+浓度2 mmol/L,引物浓度0.6 μmol/L,dNTP浓度0.1 mmol/L,其它成分为无菌双蒸水;45次循环。
应用上述体系用引物823对表1所示的8份有代表性的菜豆资源进行扩增试验,旨在检测优化后的菜豆ISSR-PCR体系效果。结果显示8份菜豆资源均能扩增出重复性好、多态性高且带型清晰的条带,表明优化后的ISSR-PCR体系稳定可靠,适用于菜豆的遗传多样性及亲缘关系等研究(图8)。
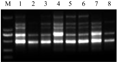 图8 引物823在8份菜豆资源中的ISSR扩增结果 注: M: DL2000 marker; 1~8: 表1所列菜豆品种 Figure 8 Result of ISSR-PCR products of 8 different varieties amplified with primer 823 Note: M: DL2000 marker; 1~8: Varieties of common bean listed in the following table 1 |
该研究采用单因素研究方法对Taq酶量、模板DNA浓度、dNTP浓度、Mg2+浓度、引物浓度、循环次数6个影响PCR反应体系的主要因素进行优化筛选分析,建立了适合菜豆的ISSR反应体系:反应总体积为25 μL,Buffer 2.5 μL,模板DNA 45 ng,Taq酶为1 U,Mg2+浓度2 mmol/L,引物浓度为0.6 μmol/L,dNTP浓度为0.1 mmol/L,其它成分为无菌双蒸水;45次循环。此体系为利用ISSR标记技术开展菜豆遗传多样性分析和构建遗传图谱奠定了基础。
2讨论
关于ISSR优化体系的建立,多数研究都认为各因素中,Taq酶浓度的影响最为主要(吴小丽等, 2007)。Taq酶用量的高低直接影响PCR产物的多少,浓度过低合成产物量少,过高则易引起非特异性扩增。本研究经比较确定Taq酶的用量为1 U,在8个品种的验证试验中效果较好。Mg2+是Taq酶实现聚合反应所必需的,Mg2+浓度低时扩增产物较少且条带较弱,可能是因为dNTP对Mg2+产生拮抗作用或降低Taq酶活性,适宜的Mg2+浓度可使PCR反应扩增结果更为清晰,这与魏鑫等(2010)的研究结果一致。在研究中发现引物及DNA浓度对PCR扩增结果影响不显著,这与何海燕等(2010)等得研究结果相一致。
ISSR反应条件的变化对扩增结果影响较大,引物的退火温度对ISSR反应的结果有重要影响,本体系中引物的退火温度是根据以往的研究所确定,扩增出的谱带比较清晰,如果选用不同的引物,还应通过试验摸索更为适合的退火温度。
3材料与方法
3.1供试材料
本研究以吉林省各科研院所近十年来审定的8份菜豆资源为试材(名称, 来源及电泳泳道见表1),于2013年1月种植于吉林农业大学园艺学院人工气候箱内,取刚展开的健康幼叶于液氮中冷冻,-80℃冰箱保存备用。
 表1 菜豆试材的名称、来源及编号 Table 1 Number, varieties and sources and of samples |
Taq酶,dNTPs等均为Fermentas产品。研究所用ISSR引物808和823的序列分别为(AG)8C和(TC)8C,由上海生工生物技术公司合成。
3.2基因组DNA提取
采用植物基因组DNA提取试剂盒提取菜豆DNA,用紫外分光光度计和0.8%琼脂糖凝胶电泳检测DNA 的浓度和纯度。将所提基因组DNA稀释到10 ng/μL,保存于-18℃冰箱备用。
3.3 PCR-ISSR反应体系设计及程序
ISSR-PCR的反应程序为:94℃预变性5 min;以下程序循环40次:94℃变性40 s,54℃退火45 s,72℃延伸80 s;最后于72℃延伸8 min,于4℃终止反应保存(表2)。
|
表2 ISSR反应体系优化设计 Table 2 Design of optimal ISSR reaction system |
3.4 PCR产物的检测
ISSR-PCR的扩增产物用1%的琼脂糖凝胶电泳进行检测。取1.5 μL溴酚蓝指示剂与7.5 μL扩增产物于一次性PE手套上吸打混匀后缓慢加入点样孔中,在0.5×TBE的电泳缓冲液中120 V恒压电泳,时间约为40 min。
作者贡献
杨晶是本试验的试验设计和试验研究的执行人,并完成数据处理分析及论文初稿的写作;张广臣是本研究的构思者及负责人,指导试验设计和论文的修改;全体作者都阅读并同意最终的文本。
致谢
本研究所用试验材料由吉林市农业科学院园艺所、吉林省蔬菜花卉科学研究院、吉林农业大学园艺学院和长春市农业科学院园艺所提供,感谢以上单位的支持与帮助;感谢吉林农业大学吴春燕老师的悉心指导。
参考文献
Beebe S., Skroch P.W., Tohme J., Duque M.C., Pedraza F., and Nienhuis J., 2000, Structure of genetic diversity among common bean landraces of middle American origin based on correspondence analysis of RAPD, Crop Sci., 40(1): 264-273
Gu Y., Han Q.H., Wang W.T., Li S.W., Sun D.L., and Wu F., 2011, Application of common bean anthracnose resistance gene SCAR markers in snap bean disease resistance identification, Yuanyi Xuebao (Acta Horticulturae Sinca), 38(5): 911-920 (古瑜, 韩启厚, 王武台, 李素文, 孙德岭, 吴锋, 2011, 普通菜豆抗炭疽病基因定位菜豆抗炭疽病基于SCAR标记在品种抗性鉴定中的应用, 园艺学报, 38(5): 911-920)
He H.Y., Sha W., and Zhang Y.F., 2010, Optimization for ISSR-PCR reaction system of soybean, Dadou Kexue (Soybean Science), 29(3): 510-513 (何海燕, 沙伟, 张艳馥, 2010, 大豆ISSR-PCR反应体系的优化, 大豆科学, 29(3): 510-513)
Li H., Li B., Zhao H.B., Yang W.Y., and Yang Z., 2012, ISSR analysis of alfalfa germplasm resources, Caodi Xuebao (Acta Agrestia Sinice), 20(1): 96-101 (李红, 李波, 赵洪波, 杨蔚然, 杨曌, 2012, 苜蓿种质资源遗传关系的ISSR分析, 草地学报, 20(1): 96-101)
Luan F.S., and Zu Y.G., 2002, Repd diversity of germplasm resources on Phaseolus vulgaris Ⅰ, Zhiwu Yanjiu (Bullentin of Botanical Research), 22(4): 473-478 (栾非时, 祖元刚, 2002, 菜豆种质资源RAPD多样性的研究Ⅰ, 植物研究, 22(4): 473-478)
Mao W.W., Ma J.J., Bo T.Y., Gao H.S., and Chen X.H., 2006, Study on optimization for ISSR reaction system in Brassica campestris L. ssp. Chinensis var utilis Tsen et Lee using orthogonal design, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 4(6S): 137-141 (冒维维, 马金骏, 薄天岳, 高红胜, 陈学好, 2006, 正交设计优化菜薹ISSR反应体系研究, 分子植物育种, 4(6S): 137-141)
Qiu Y.X., Fu C.X., and Kong H.H., 2002, Inter-simple sequence repeat (ISSR) analysis of different cultivars in Myrica rubra, Nongye Shengwu Jishu Xuebao (Journal of Agricultural Biotechnology), 10(4): 343-346 (邱英雄, 傅承新, 孔航辉, 2002, 杨梅不同品种的ISSR分析, 农业生物技术学报, 10(4): 343-346)
Sun X.D., 2003, Phylogeny of genus of bean (Phaseolus vulgaris L.) in Heilongjiang province by RAPD, Thesis for M.S., Northeast Agrieultural University, Supervisor: Qin Z.W., pp.31-33 (孙晓丹, 2003, 油豆角(Phaseolus yulgaris L.)主要种质资源亲缘关系的RAPD分析, 硕士学位论文, 东北农业大学, 导师: 秦智伟, pp.31-33)
Tantasawat P., Trongchuen J., Prajongjai T., Seehalak W., and Jittayasothorn Y., 2010, Variety identification and comparative analysis of genetic diversity in yardlong bean (Vigna unguiculata spp. sesquipedalis) using morphological characters, SSR and ISSR analysis, Sci. Hortic., 124(2): 204-216
Tian T., Feng G.J., Sheng H., Liu D.J., Zhao C.M., and Wang J., 2012, Research of SSR molecular markers for Phaseolus vulgaris L. variety identification, Beifang Yuanyi (Northern Horticulture), (4): 111-113 (田甜, 冯国军, 盛慧, 刘大军, 赵春梅, 王杰, 2012, SSR分子标记对菜豆品种鉴定的研究, 北方园艺, (4): 111-113)
Wang K., Wang X.M., Zhu Z.D., Zhao X.Y., Zhang X.Y., and Wang S.M., 2009, Mapping of a novel anthacnose resistance gene using SSR markers in common bean (Phaseolus vulgaris L.), Zuowu Xuebao (Acta Agronomica Sinica), 35(3): 432- 437 (王坤, 王晓鸣, 朱振东, 赵晓彦, 张晓艳, 王述民, 2009, 以SSR标记对普通菜豆抗炭疽病基因定位, 作物学报, 35(3): 432-437)
Wei X., Wei Y.X., Wang Y., Liu C., Wang X.D., and Dong W.X., 2010, Optimization of the inter-simple sequence repeat reaction system and its verification in Ping'ou hybrid hazelnut, Beifang Yuanyi (Northern Horticulture), (4): 125-128 (魏鑫, 魏永祥, 王颖, 刘成, 王兴东, 董文轩, 2010, 平欧杂种榛ISSR反应体系的优化与验证, 北方园艺, (4): 125-128)
Wu X.L., Wang S.B., Cao B.S., Liu J.B., and Pan B.G., 2007, Optimization for ISSR-PCR system in Capsicum annuum L., Jiangxi Nongye Daxue Xuebao (Acta Agriculturae Universitis Jiangxiensis), 29(2): 288-291 (吴小丽, 王述彬, 曹碚生, 刘金兵, 潘宝贵, 2007, 辣椒ISSR-PCR体系优化, 江西农业大学学报, 29(2): 288-291)
Zeng L., Li M.Q., Yang X.M., Zhao L.J., and Yang F.R., 2012, Establishment and optimization of ISSR reaction system for pea, Caodi Xuebao (Acta Agrestia Sinica), 20(3): 536-539 (曾亮, 李敏权, 杨晓明, 赵丽娟, 杨发荣, 2012, 豌豆ISSR- PCR反应体系的建立和优化, 草地学报, 20(3): 536-539)
Zhao G.F., 2003, Genome fingerprinting of pear cultivars by ISSR, Thesis for M.S., Agrieultural University of Hebei, Supervisor: Zhang Y.X., pp.22-25 (赵国芳, 2003, ISSR对梨属(Pyrus L.)栽培品种基因组的指纹分析, 硕士学位论文, 河北农业大学, 导师: 张玉星, pp.22-25)
Zietkiewicz E., Rafalski A., and Labuda D., 1994, Genome fingerprinting by simple sequence reapeat (SSR)-anchored polymerase chain reaction amplification, Genomics, 20(2): 176-183