2.东北林业大学盐碱地生物资源环境研究中心, 哈尔滨, 150040
3.海南省农作物分子育种重点实验室, 海南省热带农业资源开发利用研究所, 三亚, 572025
 作者
作者  通讯作者
通讯作者
豆科基因组学与遗传学, 2011 年, 第 2 卷, 第 5 篇 doi: 10.5376/lgg.cn.2011.02.0005
收稿日期: 2011年04月28日 接受日期: 2011年06月09日 发表日期: 2011年06月28日
Zeng et al., 2011, Cloning and Expression of an Alcohol Dehydrogenase from Lotus japonicus and Characterization of LjADH1, Legume Genomics and Genetics (online), Vol.2 No.2 pp.6-13 (doi: 10.5376/lgg.2011.02.0002)
乙醇脱氢酶(Alcohol Dehydrogenase ADH)是一种广泛分布在生物体中的酶,通常以NAD+和NADP+为辅酶。乙醇脱氢酶在植物的生长、发育和抗逆性中都发挥着重要的作用。本研究用原产于日本宫古岛的二倍体百脉根(Lotus japonicus) MG20为材料,借助ADH基因的保守性在百脉根cDNA中克隆同源基因,并对基因进行表达与酶特性分析。该基因全长为1 143 bp,编码了380个氨基酸。同源比对结果表明,该序列编码蛋白的氨基酸序列和ADH类蛋白具有较高同源性,推测属于锌结合乙醇脱氢酶家族蛋白,我们将其命名为LjADH1。将该基因连结到原核表达载体pQE30和真核表达载体pYES2,构建成pQE30-LjADH1和pYES2-LjADH1,并且分别转入大肠杆菌M15和酵母INVScl中。通过对诱导条件的优化,在大肠杆菌中表达了具有乙醇脱氢酶活性的His融合重组蛋白,表达量为1.12 mg/mL,酶活性48.2 U/mg。通过在原核和真核的抗逆性研究,我们发现该LjADH1基因的过量表达提高了原核重组菌株对过H2O2的抗性。在CuCl2, CdCl2及H2O2的胁迫下,pYES2-LjADH1重组酵母长势明显好于pYES2酵母菌,而对NiCl2胁迫反应不明显。我们的研究初步说明LjADH1在是一个锌结合乙醇脱氢酶家族蛋白具有一定的抗非生物胁迫的能力。
乙醇脱氢酶(Alcohol dehydrogenase, ADH, EC- 1.1.1.1)是一种底物广泛性酶,能够以NAD+为辅酶,催化伯醇和醛之间的可逆反应。在辅酶存在的条件下,它催化包括乙醇在内的某些一级或二级醇、醛和酮的脱氢反应,脱下的氢由NAD+接受,使之成为还原型辅酶Ι。
ADH广泛分布于各类植物及器官中,其作用包括参与果实的发育、成熟和衰老(Chervin, 1999),在植物抗逆性中也具有一定作用。能被脱水寒冷诱导表达(Dolferus et al., 1994)、缺氧诱导表达(Newman and Vantoai, 1992)以及与Ca2+信号转导相关(Chung and Ferl, 1999)。很多植物中ADH的长度大都为370~380个氨基酸,螺旋、折叠和卷曲3种折叠结构分布较为均匀。各个物种之间其二级结构差异不大,尤其是在保守功能域部分,即使有个别氨基酸的不同,但是肽链的折叠状态的差异性仍然很小,这预示着高度保守的二级结构与功能的稳定有着紧密的联系。同时各物种间高度保守的序列表明乙醇脱氢酶在植物生长中发挥着重要作用,以至于任何一点突变都会招致植株的死亡。
对ADH基因的研究最初是在玉米(Zea mays)中开始的,研究人员先后从玉米中克隆了两个ADH同工酶基因ZmADH1和ZmADH2 (Gerlach et al., 1982),两个ADH基因在核苷酸上有82%的相似性,氨基酸序列有87%的相似性,两者的近似关系表明它们可能由同一祖先进化而来,但是定位于不同的染色体上,ZmADH1被定位于第1染色体,ZmADH2被定位于第4号染色体。迄今为止,葡萄(Vitis vinifera)、马铃薯(Solanum tuberosum)、水稻(Oryza sativa)和小麦(Triticum monococcum)中已经有关于ADH1和ADH2基因的报道。在拟南芥中,AtADH1基因被定位于第1染色体的28 980 288~28 982 311位置,但迄今尚未见AtADH2基因的相关注释和报道。在百脉根中,已经从四倍体的百脉根(Lotus corniculatus)中鉴定了LcADH1 (GenBank ID: AA-O72531.1),但尚未有关于在二倍体的百脉根中鉴定出LjADH1或LjADH2基因的报道。
百脉根属于豆科(Leguminosae)蝶形花亚科(Papillionoideae)百脉根属(Lotus),生活周期大约为2~3个月。由于四倍体百脉根(Lotus corniculatus)基因组较大,因此一般研究都采用二倍体百脉根(Lotus japonicus)作为研究对象(Handberg, 1992)。二倍体的百脉根细胞的染色体数目多为2n=12,基因组总长度约为470 Mb。随着百脉根全基因组测序的完成,从上世纪90年代初开始,其已经成为豆科植物遗传学与基因组学研究的的模式植物。本研究用原产于日本宫古岛的百脉根MG20种系为材料(Kawaguchi, 2000),借助ADH基因的保守性,在百脉根cDNA中克隆同源基因,并对基因进行表达与酶特性进行分析。
1结果与分析
1.1 LjADH1的克隆及序列分析
本研究根据LcADH1序列信息设计引物,以百脉根MG20 cDNA为模版,从百脉根中克隆到一个长度为1 143 bp的同源序列,编码380个氨基酸。序列相似性分析发现其与百脉根基因组中一个序列的同源性达99% (GenBank ID: CAG30579.1),我们推测该序列可能为百脉根ADH1基因,并将其命名为LjADH1 (GenBank Accession No.: JN165714)。
LjADH1蛋白序列与玉米(Zea mays)、一粒小麦(Triticum monococcum)、水稻(Oryza sativa)、拟南芥(Arabidopsis thaliana)、百脉根(Lotus corniculatus)、拟山羊草(Aegilops speltoides)、葡萄(Vitis vinifera)、马铃薯(Solanum tuberosum)和高山芒(Miscanthus transmorrisonensis)的ADH蛋白序列进行多重序列比对(图1)。结果表明,本研究从MG20克隆到的ADH蛋白序列与上述已知物种的ADH序列间具有非常高的同源性,除了与MtADH间的同源性为80%外,与其它序列的同源性均在95%以上。这和石之光对ADH家族的研究一致,植物的ADH蛋白都具有保守的锌结合位点、ADH_N以及NADB_Rossmann保守结构域(石之光等, 2009)。系统进化分析表明百脉根LjADH1与拟南芥的ADH基因归属同一进化分支(图2)。
 图1植物ADH家族成员同源序列的比较 Figure 1 Homologous analysis of amino acid sequences among plant ADH family |
 图2植物物种间的ADH进化树构建 Figure 2 Phylogenetic tree of ADH in plants |
1.2原核表达载体构建
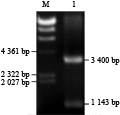
为了在体外表达百脉根乙醇脱氢酶,我们采用了目前常用于蛋白质表达的原核表达载体pQE30。其特点是带有6个组氨酸标记,与目的表达蛋白相比,标记氨基酸的影响作用可忽略且易于纯化蛋白,因此广泛应用于各种蛋白的原核表达(wang et al., 2010; liu et al., 2011)。本研究构建了原核表达质粒pQE30-LjADH1,该质粒经过BamHⅠ和SacⅠ双酶切后,琼脂糖凝胶电泳鉴定观察到一条3.4 Kb和1.1 Kb大小的片段(图3),与pQE30及目的基因序列大小一致,证明本研究正确构建了pQE30- LjADH1表达载体。
|
|
1.3融合蛋白表达及浓度测定
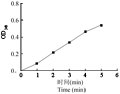
为了检测融合蛋白在大肠杆菌中的表达情况,我们将pQE30-LjADH1转化大肠杆菌M15菌株,对融合蛋白质的表达条件进行了优化。结果表明,重组质粒在IPTG的诱导下产生了重组蛋白,随着诱导时间的延长,重组蛋白的表达量也分别逐渐增大,经过条件摸索,我们得出重组蛋白的最适合诱导IPTG浓度为0.1 mmol/L,诱导温度为30℃,诱导时间在180~240 min时,诱导蛋白的表达量达到最大值(图4)。纯化的融合蛋白通过BCA蛋白浓度测定,6×His-LjADH1蛋白浓度为1.12 mg/mL。
|
|
1.4融合蛋白酶活测定
我们推测本研究原核表达的蛋白是一个脱氢酶,因此利用瓦勒和霍赫法(Vallee and Hoch, 1955)对蛋白酶活进行了测定,测定酶活性的原理是鉴于NADH和NAD+在340 nm及260 nm处有各自的最大吸收峰,当NAD+转化成NADH时会发生吸光度的变化,而吸光度的变化值和酶促反应的速率成正比,因此以NAD+为辅酶的各种脱氢酶类都可通过340 nm光吸收值的改变来测定酶的含量。一个乙醇脱氢酶酶活单位相当于在37℃下每分钟还原1 μmol NAD+时所需的酶量。通过瓦勒和霍赫法在加入辅酶Ⅰ和底物乙醇后,反应液吸光度在340 nm有显著变化(图5),证明在反应中生成了还原性的NADH,使得在340 nm出现吸光度,测得LjADH1乙醇脱氢酶每分钟吸光度变化为0.108,根据乙醇脱氢酶酶活力计算公式,U/mg=E340×3.1/(6.2×EW)。E340为340 nm处5 min吸光度吸光度增大的单位(0.001),EW为每毫升所用酶液中含酶的重量(mg)测得LjADH1酶活为48.2 U/mg。
|
|
1.5 原核表达融合蛋白抗性分析
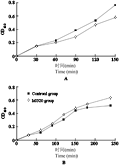
将重组M15菌株和含pQE30空载体的E. coli M15菌株分别加入H2O2,进行抗逆性分析(图6),结果表明在未加入H2O2的时候,含pQE30空载体的E. coli M15菌株的生长状况优于重组载体组菌株。这可能是细菌过量表达异源蛋白反而影响细菌生长。但在加入终浓度为1 mmol/L H2O2时,重组质粒菌株生长状态则优于含PQE30空载的E. coli M15菌株,这说明LjADH1融合蛋白的过量表达提高了菌株对H2O2的抗性,使重组载体菌株生长状况明显优于非重组载体菌株。这也表明LjADH1融合蛋白在提高原核细胞的抗氧化上有一定作用,能够在氧化胁迫下提高原核细胞的生存力。
|
|
1.6真核表达载体pYES2-LjADH1构建
酵母是一种单细胞真核微生物,具有生长迅速、易于遗传操作和可表达外源蛋白等特点。同时,它能对外源蛋白进行翻译后的加工和修饰,而这是原核表达系统所不及的(Liu et.al 2010, Wang et.al 2010)。本研究构建了真核表达载体pYES2-LjADH1,将构建的pYES2-LjADH1表达载体用BamHⅠ和XbaⅠ进行双酶切,琼脂糖凝胶电泳鉴定显示一条5.9 Kb和1.1 Kb片段(图7A),与pYES2以及目的基因序列大小一致,表明本研究正确构建了pYES2-LjADH1表达载体。将表达载体进行菌落PCR鉴定,表明表达载体成功转入酵母中(图7B)。
|
|
1.7真核表达的LjADH1蛋白抗性分析
为了研究LjADH1在不同逆境胁迫下的功能,本实验将含有pYES2-LjADH1和pYES2的酵母菌(阴性对照)以不同浓度分别培养于材料与方法中介绍的不同逆境处理的YPG培养基中,对进行抗逆性的非生物胁迫进行分析(图8)。结果表明,pYES2- LjADH1重组酵母和pYES2酵母菌在无逆境处理的YPG培养基条件下生长情况相似。在10 mmol/L CuCl2、100 μmol/L CdCl2、150 μmol/L CdCl2和3.5 mmol/L H2O2的胁迫下pYES2-LjADH1重组酵母长势明显好于pYES2酵母菌。而在1.8 mmol/L NiCl2的差异不明显。Cd2+和Cu2+类重金属离子引起的胁迫属于氧化胁迫,这说明LjADH1基因表达的乙醇脱氢酶在氧化胁迫中对酵母的生长具有一定抗逆作用。在3.5 mmol/L H2O2胁迫下,pYES2-LjADH1重组酵母长势也明显好于pYES2酵母菌,这一结果也间接说明ADH具有一定的抗非生物胁迫的能力。已有研究表明ADH的突变能导致植物抗涝性下降,但单纯过量表达ADH并不能提高植物的抗涝性(Ismond et al., 2003)。显然LjADH1的这方面的抗逆性尚有待于进一步研究。
|
|
2讨论
在本研究中,我们从二倍体百脉根MG20品种中克隆出了乙醇脱氢酶基因,并认为该基因编码一种典型的锌结合乙醇脱氢酶。我们将其命名为LjADH1。
在本实验中,我们将LjADH1基因连接到pQE30蛋白表达载体并加上6×His标签,优化诱导条件,通过Ni+-NTA凝胶纯化并获得大量高纯化的非变性蛋白。利用瓦勒和霍赫法对蛋白酶活进行了测定,发现融合蛋白具有较强的乙醇脱氢酶活性。在对LjADH1蛋白原核抗性分析中发现,LjADH1的过量表达后,重组菌株生长状态明显好于对照组,这表明融合蛋白在原核生物的表达中表现出较强的抗氧化性。同时,我们再将LjADH1基因连接pYES2载体后转入酵母中,在酵母中过量表达该基因,发现在10 mmol/L CuCl2、100 μmol/L CdCl2、150 μmol/L CdCl2和3.5 mmol/L H2O2胁迫下,pYES2-LjADH1重组酵母长势明显好于pYES2酵母。而在1.8 mmol/L NiCl2的胁迫条件下,重组酵母与对照差别不明显。这说明LjADH1基因表达的乙醇脱氢酶在氧化胁迫中的对酵母的生长具有一定抗逆作用。我们的研究初步说明LjADH1在是一个锌结合乙醇脱氢酶家族蛋白具有一定的抗非生物胁迫的能力。
3材料与方法
3.1供试材料
百脉根(Lotus japonicus L) MG20种子由中山大学教授罗达博士提供,并由海南省热带农业资源研究所保存。百脉根种子经消毒灭菌后,在30℃恒温室培养24 h萌发,选取萌发的种子播种到5×7 cm的花盆中,光照12 h/d,培养温度为26℃,培养14 d后,取全株洗净备用。
大肠杆菌JM109、酵母菌株INVScl (Clontech)、E. coli M15、pMD18-T (TaKaRa)、原核表达载体质粒pQE30 (Qiagen)及酵母表达载体pYES2 (Clontech)均由东北林业大学盐碱地生物资源环境研究中心提供。限制性内切酶、EX Taq TM、T4 DNA 连接酶和卡那霉素(Kana)等酶及试剂均购自Takara公司。
3.2 cDNA获得、基因克隆及序列分析
百脉根总RNA提取采用Biozol RNA小量提取试剂盒(Biomiga)进行。百脉根MG20的cDNA采用RNA kit (AMV)反转录试剂盒(Takara)通过RT-PCR法获得,RT-PCR程序为30℃,10 min;42℃,15 min;50℃,15 min;55℃,15 min;60℃,15 min;90℃,10 min;5℃,5 min;进行30个循环。
本研究根据已知的ADH序列信息设计了一对PCR引物,上游引物为5'-TAGCTATGTCGACCACAGCT-3',下游引物为5'-AACTCAGTCCCCAAATAGGG-3'。以百脉根MG20的cDNA为模板,PCR反应程序为95℃预变性3 min;95℃变性30 s,52℃退火30 s,72℃延伸2 min,进行30个反应循环;最后在72℃延伸10 min。PCR产物在1%琼脂糖凝胶中电泳30 min后,紫外灯下切取含有目的片段凝胶。胶回收后将纯化后的PCR产物连接到pMD18-T载体,转化大肠杆菌JM109,对阳性克隆进行测序(华大基因测序),在NCBI数据库中进行相似性比对,绘制基因序列进化树。
3.3原核表达载体构建
利用Primer Premier5.0软件设计上游引物和下游引物,并在上游引物上加上BamHⅠ酶切位点,在下游引物加上SacⅠ位点。上游引物为5'-GGGATCCATGTCGACCACAGCT-3' (下划线为BamHⅠ位点),下游引物为5'-CGGAGCTCACACATCATTGTTTTTG-3' (下划线为SacⅠ位点)。以测序载体为模板,进行PCR反应,PCR反应程序为95℃预变性3 min;95℃变性30 s,54℃退火30 s,72℃延伸2 min,进行30个反应循环;最后在72℃延伸10 min。回收PCR产物并连接到pMD18T载体,重组载体命名为pMD18T-LjADH1,热激法转入JM109菌株;菌液PCR以及双酶切鉴定后,提取重组载体质粒及pQE30载体,利用SacⅠ和BamHⅠ限制性内切酶分别进行酶切,回收后连接到pQE30载体上构建成pQE30-LjADH1,转化到大肠杆菌JM109。随机挑取单克隆,提取质粒DNA,用BamHⅠ和SacⅠ双酶切鉴定并转化大肠杆菌M15菌株。
3.4融合蛋白的诱导表达及浓度测定
将含有重组质粒pQE30的大肠杆菌M15单克隆接种到于抗性培养基中,37℃振荡培养过夜;取200 μL过夜培养物,分别加入到含抗性的5 mL LB液体培养基的摇菌管中,37℃振荡培养,当菌液达到对数生长期OD600=0.6时,加入终浓度为0.1 mmol/L的IPTG,37℃振荡培养,进行融合蛋白的诱导表达;当菌液分别诱导至0 min、30 min、60 min、120 min、180 min、240 min、300 min和360 min时,收集菌液;14 000 r/min 4℃离心1 min菌液,弃上清液,加入PBS重新悬浮沉淀,再加入等量的2×SDS上样缓冲液,100℃变性5 min,于冰上放置5 min后,13 000 r/min 4℃离心5 min。取约20 mL的上述样品进行SDS-PAGE电泳。
蛋白质浓度测量使用BCA法(Walker, 1994)。37.5 μL 8 mg/mL BSA加入262.5 μL 稀释溶液(ddH2O) 总体积为300 μL (BSA: 1 mg/mL),取150 μL连续倍比稀释7次。得到BSA标准溶液500 μg/mL、250 μg/mL、125 μg/mL、62.5 mg/mL、31.25 mg/mL、15.625和7.813 μg/mL。以ddH2O为对照,在分光光度计下测OD595。将纯化的融合蛋白稀释。每一稀释度标准溶液各取100 μL,与2 400 mL 考马斯亮蓝(Coomassie Brilliant Blue, CBB)混合。以ddH2O为对照,用分光光度计测OD595;每一稀释度重复3次。
3.5融合蛋白酶活测定
乙醇脱氢酶活性测定采用瓦勒和霍赫法(Vallee and Hoch, 1955)并稍加改动。将150 μL焦磷酸钠缓冲液,50 μL底物溶液和100 μL辅酶Ⅰ溶液加入试管中,置于37℃恒温水浴,加入同条件浴热的酶液10 μL,立即记时,在连续5 min内,每隔1 min读取340 nm处的吸光度直至每分钟吸光度增大值达到稳定为止。
3.6原核融合蛋白抗性分析
原核抗性分析按照Echave等的方法并稍有改动(Echave et al., 2003),将分别含重组载体以及仅含pQE30空载体的2.5 mL E. coli M15菌液分别培养至OD600≈0.3,加入22.5 mL含有100 μg/mL Amp和25 μg/mL kana的LB液体培养基以及终浓度为0.1 mmol/L的IPTG将菌液稀释10倍,并将菌液等量分为两组,其中一组加入终浓度为1 mmol/L的过H2O2,另一组不作处理作为对照,在30℃摇床下剧烈震荡,每隔30 min测定其OD600,以检查各时间段菌株的生长状况。
3.7酵母表达载体构建
根据本研究克隆的LjADH1基因碱基序列信息特点设计引物,上游引物:5'-GGGATCCATGTCGACCACAGCT-3' (BamHⅠ),下游引物:5'-CGTCTAGAACACATCATTGTTTTTG-3’ (XbaⅠ),将pMD18T-LjADH (酶切位点为BamHⅠ和XbaⅠ)和pYES2载体分别用BamHⅠ和XbaⅠ双酶切,回收和连接双酶切产物,重组载体命名为pYES2- LjADH1。酵母转化采用LiAc/PEG化学转化法(Gietz et al., 1995)将构建好的质粒pYES2-MGADH和载体pYES2导入到酵母INVScI中。
3.8真核表达蛋白抗性分析
将分别转入重组酵母pYES2-LjADH1和载体pYES2 INVScI单克隆于SC-U培养基中,30℃过夜培养,当酵母生长至OD600≈0.6时,将菌液用YPG培养基分别稀释到10-1倍、10-2倍、10-3倍、10-4倍和10-5倍,分别取pYES2-LjADH1和载体pYES2 10-1倍、10-2倍、10-3倍、10-4倍和10-5倍的酵母菌液,每个浓度取5 µL,分别点在于10 mmol/L CuCl2、1.8 mmol/L NiCl2、100 μmol/L CdCl2、150 μmol/L CdCl2和3.5 mmol/L H2O2的YPG培养基中,30℃培养2 d。
作者贡献
曾拓、柳参奎是本研究的实验设计和实验研究的执行人;巩鹏涛、赵德刚参与完成数据分析,论文初稿的写作;方宣钧是项目的负责人,包括负责实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究受国家科技支撑计划(2007BAD59B05)的资助。作者感谢东北林业大学盐碱地资源环境研究中心张欣欣博士在本实验过程中的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Chervin C., Truett J.K., and Speirs J., 1999, Alcohol dehydrogenase expression and alcohol production during pear ripening, American Society for Horticultural Science, 124(1): 71-75
Dolferus R., Jacobs M., Peacock W.J., and Dennis E.S., 1994, Differential interactions of promoter elements in stress responses of the Arabidopsis Adh gene, Plant Physiol., 105(4): 1075-1087 doi:10.1104/pp.105.4.1075 PMid:7972489 PMCid:159435
Echave P., Tamarit J., Cabiscol E., and Ros J., 2003, Novel antioxidant role of alcohol dehydrogenase E from Escherichia coli, Journal of Biological Chemistry, 278(32): 30193-30198 doi:10.1074/jbc.M304351200 PMid:12783863
Gerlach W.L., Pryor A.J., Dennis E.S., Ferl R.J., Sachs M.M., and Peacock W.J., 1982, cDNA cloning and induction of the alcohol dehydrogenase gene (Adh1) of maize, Proc. Natl. Acad. Sci., 79(9): 2981-2985 doi:10.1073/pnas.79.9.2981
Gietz R.D., Schiestl R.H., Willems A.R., and Woods R.A., 1995, Studies on the transformation of intact yeast cells by the LiAc/SS-DNA/PEG procedure, Yeast, 11(4): 355-360 doi:10.1002/yea.320110408PMid:7785336
Handberg K., and Stougaard J.S., 1992, Lotus japonicus, an autogamous, diploid legume species for classical and molecular genetics, The Plant Journal, 2(4): 487-496 doi:10.1111/j.1365-313X.1992.00487.x
Hwa-Jee C., and Ferl R.J., 1999, Arabidopsis alcohol dehydrogenase expression in both shoots and roots is conditioned by root growth environment, Plant Physiol., 121(2): 429-436 doi:10.1104/pp.121.2.429 PMid:10517834 PMCid:59405
Ismond K.P., Dolferus R., Pauw M.D., Dennis E.S., and Good A.G., 2003, Enhanced low oxygen survival in Arabidopsis through increased metabolic flux in the fermentative pathway, Plant Physiol., 132(3): 1292-1302 doi:10.1104/pp.103.022244 PMid:12857811 PMCid:167069
Kawaguchi M., 2000, Lotus japonicus Miyakojima' MG-20: An early-flowering accession suitable for indoor handling, Journal of Plant Research, 113(4): 507-509 doi:10.1007/PL00013961
Liu B.H., Watanabe S.H., Uchiyama T., Kong F.J., Kanazawa A., Xia Z.J., Nagamatsu A., Arai M., Yamada T., Kitamura K., Masuta C., Harada K., and Abe J., 2010, The Soybean stem growth habit gene Dt1 is an ortholog of Arabidopsis TERMINAL FLOWER1, Plant Physiology, 153(1): 198-210 doi:10.1104/pp.109.150607 PMid:20219831 PMCid:2862436
Liu Z.M., Liu S.K., Li Y.Z., and Fang X.J., 2010, Heterologous expression and purification of Cry1Ac22 toxin from Bacillus thuringiensis W015-1, Bioscience Methods, 2010, Vol.1 No.2 (DOI: 10.5376/bm. 2010.01.0002)
Liu Z.M., Zhou Y., Li Y.Z., Liu S.K., and Fang X.J., 2011, Construction of plant expression constructs harboring full-length Bt Cry1Ac22 toxin gene and truncated functional Bt Cry1Ac22 toxin gene and Arabidopsis transformation, Bioscience Methods, Vol.2, No.3 (DOI: 10.5376/bm.2011.02.0003)
Newman, K.D., and Vantoai T.T., 1992, Molecular characterization of the soybean alcohol dehydrogenase gene family amplified in vitro by the polymerase chain reaction, Plant Physiol., 100(1): 489-495 doi:10.1104/pp.100.1.489 PMid:16652988 PMCid:1075576
Shi Z.G., Ye L., Gong P.T., Zhao D.G., and Liu S.K., 2009, Analysis of alcohol dehydrogenase (ADH) family by bioinformatics, Jiyizuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(3): 429-432 (石之光, 叶磊, 巩鹏涛, 赵德刚, 柳参奎, 2009, 乙醇脱氢酶(ADH)家族生物信息学分析, 基因组学与应用生物学, 28(3): 429-432)
Vallee B.L., and Hoch F.L., 1955, Yeast alcohol dehydrogenase, a zinc metalloenzyme, Journal of the American Chemical Society, 41(6): 327-338
Walker J.M., ed., 1996, The protein protocols handbook, Humana Press Inc., Totowa, New Jersey, USA, pp.11-14 doi:10.1007/978-1-60327-259-9_3
Wang S.L., Liu S.K., Yu G.H., Gong P.T., Zhao D.G., and Fang X.J., 2010, Studies on rice Epoxide hydrolase: Gene cloning and expressing in E. coli, yeast and Arabidopsis, Rice Genomics and Genetics, Vol. No.2 (DOI: 10.5376/rgg.2010.01.0002)
Wang S.L., Liu S.K., Yu G.H., Gong P.T., Zhao D.G., and Fang X.J., 2010, Large preparation and purification of rice epoxide hydrolase expressed in Escherichia coli, Genomics and Applied Biology, Vol.1 No.5 (DOI: 10.5376/gab. 2010.01.0005)