作者
作者  通讯作者
通讯作者
豆科基因组学与遗传学, 2013 年, 第 4 卷, 第 1 篇
收稿日期: 2013年01月12日 接受日期: 2013年01月12日 发表日期: 2013年01月12日
引用格式(中文):
董薇, 余永亮, 杨红旗, 杜华, 李彩云, 2013, 农杆菌介导磷高效转录因子OsPTF1转化大豆研究, 分子植物育种, 11(6): 688-693
引用格式(英文):
Liang H.Z., Dong W., Yu Y.L., Yang H.Q., Du H., and Li C.Y., 2013, Transformation of OsPTF1 into Soybean by Agrobacterium-mediated Method, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 11(6): 688-693
本研究将水稻耐低磷基因OsPTF1基因构建植物高效表达载体pTF101.1-35S-OsPTF1-NOS,通过农杆菌介导法将OsPTF1基因转入黄淮海地区优良品种商豆1099子叶节中,成功获得转基因植株。大豆属于难转化作物,在本研究中,对大豆转基因中大豆萌发指标和侵染方式进行优化选择。结果表明:大豆转基因萌发时间以48小时为宜;大豆子叶节受体比大豆胚尖受体更容易转化。经过PCR分子初步检测,有3株转化植株整合有OsPTF1外源基因,表明OsPTF1基因已初步整合到大豆基因组中。
大豆(Glycine max)富含蛋白质和油脂,是重要的粮饲兼用作物。中国曾经是大豆出口国,但近十年来已经变成进口大国,进口量呈逐年上升的趋势。据海关总署2013年1月10日公布的数据,2012年中国大豆进口量5.838×1010kg,较上年增加11.2%,进口量占大豆总需求量的70% (http://www.customs.gov.cn/tabid/2433/infoid/413010/frtid/65602/default.aspx/)。据农业部网站2010年3月15日发布了题为《农业部就农业转基因技术与生物安全等问题答问》的报道,近年来转基因技术取得了很大的进展,通过转基因可以得到产量高、质量好、抗逆性强和抗病虫害的大豆新种质资源。但大豆属于难转化作物,转化效率较低,中国转基因大豆研究存在一些难题,如:缺少拥有自主知识产权的载体和优良有效的基因等,因此,开发具有自己产权的高产优质转基因大豆迫在眉睫。以往研究表明:用基因枪法作用于大豆的幼胚生长点和用农杆菌介导法侵染大豆的子叶节均有可能获得转基因大豆植株(De Block et al., 1984; Horsch et al., 1984; McCabe et al., 1988; Hinchee et al., 1988)。Horsch等(1985)发明了叶盘转化法,也称之叶盘。Di等(1996)、徐香玲等(1997; 1999)、Su等(1999)、卜云萍等(2003)和姬月梅等(2008)人利用农杆菌介导法得到转基因植株。Xing等(2000)成功获得不带筛选标记的大豆转基因植株。
不同大豆品种对低磷胁迫的响应不同(李青松, 2006),低磷胁迫下大豆的形态和生理生化都会发生一系列变化(董薇等, 2012),提高大豆自身利用磷素的能力,具有重大研究价值和现实意义。水稻分子育种亲本材料耐低磷胁迫存在着广泛的遗传变异(台德卫等, 2005)。水稻中的基因OsPTF1的增强表达能够增加吸收和利用磷素(Paszkowski et al., 2002)。本研究使用农杆菌介导法,利用跟癌农杆菌侵染的子叶节法,将从水稻中克隆的磷素高效吸收利用基因OsPTF1转入到黄淮大豆品种中。在不影响受体大豆品种产量、品质等性状的前提下,在构建载体过程中通过添加启动子CaMV35S和筛选基因Bar基因,提升大豆从土壤中高效吸收和利用磷素的能力,为高效利用土壤养分提供新的研究途径,为大豆新品种品质和产量改良提供新的种质资源。
1结果与分析
1.1植物表达载体pTF101.1-35S-OsPTF1-NOS的构建及其分析
挑取已经转入植物表达载体pTF101.1-35S-OsPTF1-NOS的农杆菌菌株,摇菌液繁殖进行菌液PCR (图1),结果发现菌株均可以扩增出目的片段。对这些阳性克隆挑选PCR结果较好的菌株进行酶切鉴定,酶切片段大小与预期大小一致(图2)。具体数据如下:EcoRⅠ单酶切能够得到大小为11.6 Kb单片段;EcoRⅠ、BamHⅠ双酶切能够得到大小为9.2 Kb和2.4 Kb的两个片段;EcoRⅠ、HindⅢ双酶切能够得到大小为9.0 Kb、1.3 Kb和1.1 Kb的三个片段。酶切结果见图2:泳道2为EcoRⅠ单酶切;泳道3为EcoRⅠ、BamHⅠ双酶切;泳道4为EcoRⅠ、HindⅢ双酶切。经过比对Marker,结果均与预期相符。进一步对扩增克隆载体得到的OsPTF1基因进行测序,序列分析结果表明,从水稻中扩增得到的OsPTF1基因片段与已报道序列编码相符,目的基因已成功构建植物表达载体,可以用于大豆品种的遗传转化(图3)。
|
图1 农杆菌转化结果PCR
注: M: Wide range DNA marker 500-12 000; 1~6: PCR检测OsPTF1基因; 7: 负对照 Figure 1 Agrobacterium transformation results PCR Note: M: Wide range DNA marker 500-12 000; 2~6: PCR detection OsPTF1 gene; 7: Negative control |
|
图2 载体酶切鉴定图
注: M: Wide range DNA marker 500-12000; 1: EcoRⅠ酶切; 2: BamHⅠ, EcoRⅠ酶切; 3: HindⅢ, EcoRⅠ双酶切 Figure 2 The vector digested identification results Note: M: Wide range DNA marker 500-12000; 1: Digest with EcoRⅠ; 2: Digest with BamHⅠ, EcoRⅠ; 3: Digest with HindⅢ, EcoRⅠ |
|
图3 重组植物表达载体pTF101.1-OsPTF1的示意图
Figure 3 Plasmid map of pTF101.1-OsPTF1 |
1.2大豆转化条件摸索及阳性植株的检测
1.2.1大豆萌发指标摸索
对大豆种子萌发时间设梯度,分别在暗培养及光照培养条件下设48 h、72 h和5 d三个梯度(图4)。观察种子生长情况,光照下培养大豆生长状态和在暗培养中的豆子生长在72 h以内状态一致,之后光照培养生长速度加快并产生叶绿素。培养5 d时,豆子木质化严重,根毛长出,豆子老化,内部子叶要钻破种皮,利用GUS染色只能观察到极少的染色区域。同时发现,大豆培养超过48 h后,随着培养时间增长,子叶裂缝现象严重。裂瓣带来的不良后果是:(1)侵染转化过程中在子叶节处破碎,无法制造伤口,实验终止;(2)侵染时裂瓣区域吸附大量农杆菌,共培养早期出现农杆菌污染,转化过程中止;(3)即便在共培养早期没有造成农杆菌污染,下一步组培过程中在伤口周围开始褐化,愈伤再生困难,不易诱导出正常愈伤。综上因素考虑,我们将种子培养时间定在48 h。
|
图4 大豆萌发状况
注: A~B: 48 h; C~D: 72 h; E: 5 d Figure 4 Soybean germination conditions Note: A~B: 48 h; C~D: 72 h; E: 5 d |
1.2.2大豆侵染方式比较
大豆种子选择用氯气消毒,之后接种于MS培养基里培养48 h。选择无污染且生长状态正常的种子在侵染液中浸泡5 min。准备子叶节受体:剥去种皮后,将两片子叶各保留一般胚轴切开,每片子叶只保留2~3 mm下胚轴,其余切去,在真叶长出的周围部位划3~5刀制造伤口,同时将真叶去掉。准备胚尖受体:小心分开两片子叶,注意不能撕裂胚轴,取出胚尖,下胚轴保留3~5 mm,其余部分小心切去,全部处理过程均需在无菌环境下操作。
将两种不同受体(子叶节, 胚尖)置于农杆菌液中侵染20 min,接种于共培养培养基后黑暗培养,72 h后GUS染色效果对比如图(图5),由图可见,胚尖受体染色后颜色较浅,而且生长锥部位基本无染色,但子叶节受体培养后染色,伤口处颜色深且染色位于愈伤分化部位。
|
图5 不同受体侵染后GUS染色比较
注: A~B: 胚尖; C: 子叶节 Figure 5 The different receptors infection after GUS staining comparison Note: A~B: Embryonic Tip; C: Cotyledon node |
1.2.3检测抗性植株
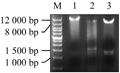
经过近一年的优化及转化试验,根据实际培养环境优化了农杆菌介导法转化大豆子叶节实验体系,获得了3株PCR阳性幼苗。叶片PCR电泳结果如图6所示,比对Marker与对照条带(1 460 bp),4、5、8泳道PCR条带呈现阳性,可以认为是与对照相同的目的条带。
|
图6 大豆基因组PCR检测目的基因电泳图
注: M: Wide range DNA marker 500-12000; 1: 正对照; 2: 负对照; 3~7: PCR扩增OsPTF1 Figure 6 PCR detection of the target gene electrophoresis Note: M: Wide range DNA marker 500-12000; 1: Positive control; 2: Negative control; 3~7: PCR amplification OsPTF1 |
2讨论
2.1大豆受体选择
受自身遗传性状的限制,与其他作物相比,大豆转基因研究比较难操作,转化率较低,导致了大豆转基因试验研究相对滞后。本研究利用植物转基因研究技术,采用农杆菌介导法将水稻中与磷高效表达有关的OsPTF1基因基因介导入高产、优质的商豆1099中,并且成功获得转基因植株。商豆1099是黄淮海地区推广种植品种,成功转化更有利于日后规模化种植。研究过程中,同样条件下,发现不同的大豆受体在农杆菌侵染后效果有明显差异。前人研究已经有过报道,刘银等(2013)、董薇(2012)和杨晓凤(2011)在进行大豆转基因之前对受体大豆品种进行了筛选,由于培养环境不尽相同,最终品种选择不同,但是都认为小粒豆更适合用于遗传转化。本研究所用品种是在黄淮海地区中粒形相对较小,同时经过试验,在培养过程中粒形完整,长势良好。为了进一步优化转化条件,提高实验的精度,我们认为:(1)大豆种子在灭菌前应仔细挑选、将种皮破裂,性状、大小不一致的种子挑出,否则,在试验培养过程中可能导致污染,破坏实验进程,同皿种子也会因污染被浪费;(2)胚尖自身营养物质储存少,培养早期对培养基依赖程度高,而子叶节因为保留有半片子叶,培养早期能为受体生长提供更好的营养,适应培养基快,生长状态好。
2.2目的基因的选择
截止目前的研究,关于植物对磷吸收利用的基因调控报道较少。随着基因组测序的发展,越来越多的基因组被完整测序,其中包含很多高亲和的磷转运体。Paszkowski等(2002)研究表明:植物中虽属同种,但是也存在很多个不同的高亲和磷转运体,水稻方面磷酸转运体被报道的已经有13表现高亲和。吴忠长(2004)使用差减扣除文库SSH,成功从水稻根的磷饥饿诱导扣除文库里,筛选得到了一系列的磷饥饿诱导的基因克隆,经过GeneBank、Monsando数据库分析其生物信息,最终获得了水稻与磷高效利用有关的基因OsPTF1,并且通过实验证明了该基因属于bHLH类转录因子。在该基因前段加入35S启动子可以诱导OsPTF1基因过表达,大约增强9倍左右。吴忠长(2004)将OsPTF1基因转入水稻中研究,得到结果显示低磷情况下,该基因过表达使水稻根部对磷的吸收有明显增强。此结果证明该基因和水稻生长耐低磷胁迫有关(吴忠长, 2004; 董薇, 2012)。该基因受外源共生菌强烈诱导,表现了植物高亲和的磷转运体在磷吸收多样性功能(Paszkowski et al., 2002)。本研究选择水稻基因OsPTF1作为目的基因是非常适合与有效的。
2.3表型鉴定工作
在研究过程中,由于愈伤培养基已经添加ppt筛选,故此没有再利用ppt涂抹叶片的方式筛选阳性植株,我们选择了利用PCR鉴定阳性植株的方法(贺熙勇等, 2008)。得到的阳性幼苗仅有3株,初步说明我们的大豆转基因方法是可行的。进一步的实验安排准备在得到更多阳性苗的前提下,采用southern杂交进一步验证阳性幼苗中目的基因的表达,并且,将阳性后代幼苗置于低磷胁迫环境中验证转基因幼苗目的基因表达带来的变化。
3材料与方法
3.1供试材料
大肠杆菌(E. coli) DH5α感受态从天根生化科技(北京)有限公司采购,DNA分子量标准DNA Maker TaKaRa Wide Maker 500-12000从久是生物公司购入。Wang Kan教授(Iowa State University)惠赠pTF101.1质粒表达载体载体,本实验室构建根癌农杆菌EHA105、质粒表达载体pCAMBIA1300-221 (简称p1300-221)和pCAMBLA1300-221载体(含有Bar基因-抗除草剂基因)。商豆1099和Jack分别由商丘市农科所和中国农科院惠赠,本研究室扩繁。
3.2试验方法
3.2.1植物表达载体构建过程
目的基因克隆:利用合成引物从水稻RNA中反转录得到的cDNA PCR扩增OsPTF1基因。对阳性克隆进行测序后,提取质粒用于转化农杆菌菌株。
添加终止子:从植物表达载体p1300-221中扩增NOS (约250 bp)。将PCR扩增胶回收得到的OsPTF1和NOS分别连接到T-Vector上。T-OsPTF1质粒和T-NOS酶切,回收产物NOS和T-OsPTF1在T4连接酶作用下过夜连接得到T-OsPTF1-Nos。酶切T-OsPTF1-NOS和原核表达载体p-1300-221,回收目的片段-OsPTF1-NOS-然后和p-1300-221连接酶过夜连接下,连接得到p-1300-221-OsPTF1-NOS。
与含启动子载体连接:双酶切回收植物表达载体载体pTF101.1和上步骤产物p-1300-221-OsPTF1-NOS质粒,酶切胶回收产物-35S-OsPTF1-NOS-和pTF101.1在T4连接酶过夜连接下得到pTF101.1- 35S-OsPTF1-NOS。
将最终连接得到的载体转化大肠杆菌DH5α,涂平板挑取单克隆,利用菌液PCR目的基因和多种酶切鉴定,挑选含有目的基因的阳性克隆单菌落;进一步测序确定阳性克隆准确无误后,裂解法从菌液中提取质粒载体转化农杆菌菌株EHA105。阳性克隆的PCR检测所用引物为:NOSUP:5’-ATGGTTACCGCTCGAATTTCCCC-3’;NOSDN:5’-GCCAGTGAATTCCCGATCTAG-3’。OsPTF1UP:5’-AGGATCCTGTAACACTTTGGAGCATCA-3’;OsPTF1DN:5’-AGAATTCAGGTCACCAGCCGTTGAGTTATTATGTC-3’ (董薇, 2012)。
3.2.2农杆菌介导大豆遗传转化
菌液准备:挑取已构建好的表达载体农杆菌单菌落,接种于含有Spect (100 mg/mL)和Rif (50 mg/mL)的YEB液体培养基中,待菌液OD600为0.4~0.6时,离心上述菌液,重悬至含有200 μL/L乙酰丁香酮的侵染液中,进行大豆子叶节侵染。
受体准备:将接种于MS培养基中的长势良好的大豆放入侵染液中,小心将种皮剥去并切去下部胚根,保留约2 mm,用消毒刀片在子叶节处制造3~5处划痕,同时要切去嫩小子叶,处理好的受体放在侵染液中等待侵染。
转化及筛选培养:划伤处理过的大豆子叶节置于菌液中侵染20 min,放置在超净台内灭菌滤纸上吹干,接种于MS培养基上黑暗培养(24℃) 3 d (应珊等, 2008),之后转接到筛选培养基中,筛选剂浓度250 μL/L,光照培养(光照10 h/d, 24℃),14 d一个周期,培养3~4个周期。
MS:1/2MS、1.5%和琼脂0.8%。
筛选培养基:B5、3%蔗糖、0.6 g/L MES、1.7 mg/L 6-BA、1.825 mg/L L-半胱氨酸、25 mg/L Na2S2O3、500 mg/L Cef、350 μL/L PPT (唐晓飞等, 2009)以及0.3%植物凝胶。
嫁接:筛选结束后愈伤组织已经长出维管束就可以嫁接了。选用刚展开子叶的大豆幼苗作为砧木,嫁接前浇透水,用镊子去掉幼苗中心的真叶,在两片子叶中间竖劈1 cm左右接口;从组培愈伤组织中选择已经长出维管束的小芽,顺着维管束方向切成楔形,插入砧木苗切口中,刀切受伤面紧密贴合,使用封口膜缠绕固定,将处理好的小苗种在小钵里并摆放在温盒里保湿培养,及时喷水保湿,7 d后可以分辨嫁接是否成活,去掉成活嫁接苗新芽旁边的腋芽,并进行光照培养(光照10 h/d,24℃)。幼苗根据试实际生长情况及时移植到稍大的花盆中。
作者贡献
梁慧珍和董薇是本研究的实验设计和实验研究的执行人;余永亮完成数据分析;杨红旗、李彩云和杜华参与实验设计,试验结果分析;梁慧珍是项目的构思者和负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家转基因重大专项(2009ZX08018001B; 2011ZX08004-005)、国家863计划(2011-G113)和河南省科技创新杰出人才计划(114200510002)共同资助。
参考文献
Bu Y.P., Wang G.K., Hu G.W., Sun H.Y., Ren Y., Li H., Li M.C., and Xing L.J., 2003, Introduction of △6-Fatty acid desaturase gene from mortieralla isabellina into soybeans by Agrobacterium infection, Shengwu Jishu (Biotechnology), 13(3): 6-8 (卜云萍, 王广科, 胡国武, 孙红妍, 任勇, 李航, 李明春, 邢来君, 2003, 深黄被孢酶△6-脂肪酸脱氢酶基因导入大豆, 生物技术, 13(3): 6-8)
De Block M., Herrera-Estrella L., Van Montagu M., Schell J., and Zambryski P., 1984, Expression of foreign genes in regenerated plants and in their progeny, EMBO J., 3(8): 1681-1689
Di R., Purcell V., Collins G.B., and Ghabrial S.A., 1996, Production of transgenic soybean lines expressing the bean pod mottle virus coat protein precursor gene, Plant Cell Rep., 15(10): 746-750
Dong W., 2012, Transformation of OsPTF1 into soybean by Agrobacterium, Thesis for M.S., Zhengzhou University, Supervisor: Tian B.M., and Liang H.Z., pp.12 (董薇, 2012, 农杆菌介导磷高效转录因子OsPTF1转化大豆的研究, 硕士学位论文, 郑州大学, 导师: 田保明, 梁慧珍, pp.12)
Dong W., Lian Y., Yu Y.L., Wang S.F., Yang H.Q., Wang T.F, and Liang H.Z., 2012, Advances in low phosphorus stress on soybean, Dadou Kexue (Soybean Science), 31(1): 135-140 (董薇, 练云, 余永亮, 王树峰, 杨红旗, 王庭峰, 梁慧珍, 2012, 大豆磷胁迫响应研究进展, 大豆科学, 31(1): 135-140)
He X.Y., Chen S.C., and Peng A.H., 2008, Review of molecular screening and detection methods of transgenic plants and improvement, Redai Nongye Keji (Tropical Agricultural Science & Technology), 31(1): 39-44 (贺熙勇, 陈善春, 彭爱红, 2008, 转基因植物的分子检测与鉴定方法及进展, 热带农业科技, 31(1): 39-44)
Hinchee M.A.W., Connor-Ward D.V., Newell C.A., McDonnell R.E., Sato S.J., Gasser C.S., Fischhoff D.A., Re D.B., Fraley R.T., and Horsch R.B., 1988, Production of transgenic soybean plants using Agrobacterium-mediated DNA transfer, Nature Biotechnol., 6: 915-922
Horsch R.B., Fraley R.T., Rogers S.G., Sanders P.R., Lloyd A., and Hoffmann N., 1984, Inheritance of functional foreign genes in plants, Science, 223(4635): 496-498
Horsch R.B., Fry J.E., Hoffmann N.L., Eichholtz D., Rogers S.G., and Fraley R.T., 1985, A smiple and general method for transferring genes into plants, Science, 227(4691): 1229-1231
Ji Y.M., Chen S.Y., Li Y.H., Zhang L.J., Song X.H., Chang R.Z., and Qiu L.J., 2008, Optimization of genetic transformation system from soybean cotyledon mediated by Agrobacterium, Dadou Kexue (Soybean Science), 27(1): 26-32 (姬月梅, 陈受宜, 李英慧, 张丽娟, 宋晓华, 常汝镇, 邱丽娟, 2008, 农杆菌介导大豆子叶节遗传转化体系的优化研究, 大豆科学, 27(1): 26-32)
Li Q.S., 2006, Study on screening of soybean cultivars with hi- gh phosphorus efficiency and its physiological mechanism, Thesis for M.S., Henan Agricultural University, Supercisor: Han Y.L., and Tan J.F., pp.4-6 (李青松, 2006, 大豆磷高效品种的筛选及磷高效的生理机制的研究, 硕士学位论文, 河南农业大学, 导师: 韩燕来, 谭金芳, pp.4-6)
Liu Y., Shi X.L., Wang J.L., Liu Q.E., and Wang Y.P., 2013, Establishment of regeneration system of soybean cotyledonary node, Yangzhou Daxue Xuebao (Journal of Yangzhou University Agricultural and Life Science Edition), 34(1): 68-72 (刘银, 史秀岚, 王静磊, 刘琪迩, 王幼平, 2013, 大豆子叶节再生体系的建立, 扬州大学学报(农业与生命科学版), 34(1): 68-72)
McCabe D.E., Swain W.F., Martinell B.J., and Christou P., 1988, Stable transformation of soybean (Glycine Max) by particle acceleration, Nat. Biotechnol., 6: 923-926
Paszkowski U., Kroken S., Roux C., and Briggs S.P., 2002, Rice phosphate transporters include an evolutionarily divergent gene specifically activated in arbuscular mycorrhizal symbiosis, Proc. Natl. Acad. Sci. USA, 99(20): 13324-13329
Su Y.H., Wang H.L., Yu M.M., Lv D.Y., and Guo S.D, 1999, Studies on transfer of Bt gene into glycine max, Acta Botanica Sinica, 41(10): 1046-1051
Tai D.W., Zhang X.Z., Su Z.S., Wang Y.L., Luo Y.C., Wu J.D., and Xia J.F., 2005, Studies on genotypes differences of the rice seedling characters under different phosphorus levels, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 3(5): 704-710 (台德卫, 张效忠, 苏泽胜, 王元垒, 罗彦长, 吴敬德, 夏家发, 2005, 不同磷营养胁迫下水稻苗期性状基因型差异的研究, 分子植物育种, 3(5): 704-710)
Tang X.F., Liu L.J., Gao M.J., Yang Z., Pu G.F., Zhang L., and Wei L., 2009, Agrobacterium-mediated transformation of hsf8 into soybean, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(3): 444-450 (唐晓飞, 刘丽君, 高明杰, 杨喆, 蒲国峰, 张雷, 魏崃, 2009, 农杆菌介导热激转录因子8基因转化大豆, 分子植物育种, 7(3): 444-450)
Wu Z.C., 2004, OsPTF1: a novel phosphorus-starvation induced transcription factor involved in tolerance for phosphorus starvation in rice (Oryza Sativa L.), Dissertation for Ph.D., Zhejiang University, Supervisor: Wu P., pp.27-48 (吴忠长, 2004, 水稻耐低磷胁迫相关转录因子OsPTF1研究, 博士学位论文, 浙江大学, 导师: 吴平, pp.27-48)
Xing A.Q., Zhang Z.Y., Sato S., Staswick P., and Clemente T., 2000, The use of the two T-DNA binary system to drive marker-free transgenic soybeans, In Vitro Cell. Dev. Biol. Plant, 36(6): 456-463
Xu X.L., Gao J., Liu W.H., and Li J.L., 1997, Studies on transferring B. t. k-delta endotoxin gene into soybean with Ti-plasmid primaril, Dadou Kexue (Soybean Science), 16(1): 6-11 (徐香玲, 高晶, 刘伟华, 李集临, 1997, Ti质粒介导的B、t、k-δ内毒素蛋白基因转化大豆的初步研究, 大豆科学, 16(1): 6-11)
Xu X.L., Zhou L.P., Liu W.H., and Li J.L., 1999, A preliminary study on transferring chitinase gene into soybeans, Dadou Kexue (Soybean Science), 18(2): 101-108 (徐香玲, 邹联沛, 刘伟华, 李集临, 1999, 向大豆导入几丁质酶基因的初步研究, 大豆科学, 18(2): 101-108)
Yang XF., 2011, Optimization of Agrobacterium-tumefacien mediated soybean transformation system using cotyledonary explants and developing of transgenic soybean with improved insect-resistant the Sporamin andChitinase KDEL gene tiansformation study, Thesis for M.S., Zhejiang University, Supervisor: Tang G.X., pp.7 (杨晓凤, 2011, 大豆农杆菌转化体系的优化及Sporamin和Chitinase KDEL基因转化研究, 硕士学位论文, 浙江大学, 导师: 唐桂香, pp.7)
Ying S., He X.W., Wang X.R., and Shou H.X., 2008, Assessment of factors affecting the transformation efficiency of soybean cotyledonary-node Agrobacterium-mediated transformation system, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 6(1): 32-40 (应珊, 何晓薇, 王秀荣, 寿惠霞, 2008, 影响农杆菌介导的大豆转化效率的因素研究, 分子植物育种, 6(1): 32-40)