2 昆明学院生命科学与技术系, 昆明学院, 650214;
3 云南农业大学植物保护学院, 昆明, 650201
 作者
作者  通讯作者
通讯作者
豆科基因组学与遗传学, 2013 年, 第 4 卷, 第 3 篇
收稿日期: 2013年03月25日 接受日期: 2013年03月25日 发表日期: 2013年03月25日
引用格式(中文):
董玉梅, 何霞红, 苏源, 李成云, 肖秋芸, 赵正龙, 朱有勇, 2013, 大豆应答玉米小斑病菌胁迫的蛋白质双向电泳分析, 分子植物育种, 11(5): 476-485
引用格式(英文):
Dong Y.M., He X.H., Su Y., Li C.Y., Xiao Q.Y., Zhao Z.L., and Zhu Y.Y., 2013, Proteomic analysis of Glycine max leaf in response to stress of Bipolaris maydis, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 11(5): 476-485
为探究大豆应答非致病菌(Bipolaris maydis)胁迫的分子机制,将玉米小斑病菌接种于3周龄的大豆苗。取48 hpi的大豆叶片以TCA/丙酮法提取蛋白质,利用蛋白质双向电泳技术分离蛋白,串联质谱(MS+MS/MS)鉴定蛋白质再结合生物信息学技术进行蛋白质功能分析。结果显示:分离到大豆苗期叶片总蛋白点1 300±15个,其中,差异表达(2倍以上, P值<0.05)的蛋白质点18个,除2个蛋白点未成功测序,其余16个差异蛋白点经GO分析可知,差异表达的蛋白质功能主要涉及光合作用、胁迫应激和非寄主抗性响应,如核酮糖1,5-二磷酸羧化酶、病程相关蛋白PR-10和细胞骨架结构相关蛋白profilin-2。同时,由测序结果推测:在非致病菌(玉米小斑病菌)的胁迫下,大豆通过降低光合作用相关蛋白和能量代谢相关蛋白的表达,来增强防御相关蛋白和非寄主抗性相关蛋白的表达。
高生产力、可持续和环境友好型作物生产方式已经成为全球农业的发展趋势。同单作或净作(Monocultured cropping, 单一种植一种作物)相比,以间套作或混作为主的多样性种植方式不仅能有效提高土地、光热资源利用率和产量,还可降低化肥和农药用量、减少因病害带来的作物减产(Zhu et al., 2000; Li et al., 2009; Shukla et al., 2010)。
作物总是暴露在始终有微生物的环境中生长,微生物为了生存各自找寻自己的寄主植物进行取食、生长和繁殖等过程(Cameron et al., 2006),而作物受微生物(致病或非致病的)胁迫时,通常会经过自我或非我的识别(Detection)、信号转导(Signaling)和防御反应(Response)来抵抗微生物的入侵,这些防御反应包括广谱的基础防御(Basal defense)或非寄主抗性(Nonhost resistance),和针对病原菌小种特异性的抗病性(Specific resistance) (Jones and Dangl, 2006; Tiffin and Moeller, 2006)。在多样性种植系统中一些不能使某种作物致病的微生物是该作物的非致病菌(Non-adapted pathogens),该作物同非致病菌的互作属于非亲和互作范畴,引起的抗性属非寄主抗性(Cameron et al., 2006; Heath, 2000)。
一些组成型和诱导型表达的细胞成分在非寄主抗性中起到了重要作用,如果将这些成分破坏或不让其表达细胞则丧失对某种非致病菌的非寄主抗性。如将微丝降解,或利用细胞松弛素破坏微丝结构将导致植物对几种非致病菌的非寄主抗性丧失(Yun et al., 2003; Shimada et al., 2006)。诱导表达的非寄主抗性表现,如胞壁加厚、细胞壁木质化、胼胝质的累积、酚类的累积、皂甙的产生、植保素的产生、乳突的形成、细胞内H+和Ca2+的升高、活性氧爆发、过敏反应、脱落酸合成、茉莉酸合成、PR蛋白的合成以及MAP激酶信号转导级联反应等(Heath, 2000; Daxberger et al., 2007)。一旦以上生物学过程相关蛋白的表达受限或被破坏,植物就会由抗病变为感病。同理,如果植物在应答非致病菌胁迫时不发病,但可检测到上述任何组成型或诱导型蛋白的差异表达,则可推测植物产生了非寄主抗性。
大豆(Glycine max)因其种子富含植物蛋白和油而成为全球性的重要作物(Sobhanian et al., 2010)。在中国南方,玉米(单子叶植物)/大豆(双子叶植物)是经典的间作模式。为探索玉米/大豆间作对作物病害调控的分子机制,本课题组前期研究结果显示:①玉米小斑病菌是大豆的非致病菌,而大豆是玉米小斑病菌的非寄主植物;②玉米小斑病菌接种后对大豆叶片细胞中过氧化氢(H2O2)的DAB染色观察(潘满华, 2012)和胼胝质沉积观察(董玉梅等, 2013);③防御酶系(PAL, POD和SOD)活性测定结果显示受小斑病菌胁迫时大豆叶片中的PAL、POD、SOD酶活性呈差异表达(潘满华, 2012);④防御相关基因的实时荧光定量PCR结果显示,受玉米小斑病菌胁迫,大豆的Actin、PR10、和Chib1等15个备选基因中,上调幅度最大的是PR1a和GLU (潘满华, 2012)。为进一步明确大豆应答玉米小斑病菌胁迫的差异表达蛋白及其功能,本研究利用TCA-丙酮沉淀法提取大豆叶片蛋白质,结合基于凝胶的双向电泳方法分离蛋白质,再利用蛋白质质谱技术(MS+MS/MS)和生物信息学分析技术,旨在揭示大豆对玉米小斑病的非寄主抗性成分及其相关蛋白质功能分类。
1结果与分析
1.1大豆叶总蛋白双向电泳结果
接种后48 h (48 hpi),分离对照和处理的叶片总蛋白质,进行双向电泳、凝胶染色、脱色和扫描后获得双向电泳凝胶图(图1)。经PDQuest 7.4软件进行分析可知处理和对照的凝胶上都分离到1 300±15个蛋白点,能够满足图谱分析和后期蛋白质挖点送质谱分析的要求。其分子量和等电点分布趋势统计结果显示:大豆苗期叶片总蛋白质的相对分子量在25~75 kD间的蛋白点占总蛋白点的77%,而小于25 kD和大于75 kD的蛋白点分别占总蛋白的11%和12%;等电点分布在pI 5~6间的蛋白点占总蛋白的52%,而pI小于5、大于6的蛋白点分别占总蛋白点的17%和31% (图2)。
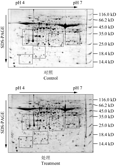 图1 大豆叶片总蛋白双向电泳凝胶图 Figure 1 Two-DE gel maps of the total proteins of Glycine max leaf |
.png) 图2 大豆叶片总蛋白分子量和等电点分布趋势图 Figure 2 Tendency of Mr and pI distribution of protein spots in 2-DE gel maps |
考虑到受IPG胶条的pH 4~pH 7值范围和标准蛋白Marker (包括116 kD, 66.2 kD, 45 kD, 35 kD, 25 kD, 18.4 kD和14.4 kD)条带的限制,分子量分别小于25 kD和大于75 kD,以及等电点分别小于5和大于6的蛋白点的百分比可能会随IPG胶条的变化而有所变化,但其大多数蛋白点的分子量在25~75 kD间、等电点在5~6之间的分布趋势是准确的。即可知大豆苗期叶片总蛋白质中,相对分子量分布在25~75 kD之间的蛋白点占一半以上,等电点分布在5~6之间的蛋白点占一半左右(图1; 图2)。
1.2大豆应答玉米小斑病菌(Bipolaris maydis)胁迫的蛋白质功能分析
1.2.1经分析获14个有效差异蛋白点
PDQuest 7.4软件分析:包括胶点(Spot)检测、相对分子量和等电点赋值、匹配和标注等。有18个蛋白点是对照和处理间表达倍数达2倍(p<0.05)及以上,挖点测序、数据分析显示:5和7号两个点匹配肽段数太少(<3),不符合蛋白质功能预测的最低肽段匹配要求(≥3)。其余的16个差异蛋白点中,6和9号两个点在GO数据库中Blast时,与拟南芥数据库中序列比较的P value<1-e5而不能用于功能分类。因此,测序后的有效蛋白点共14个,其中与对照相比,8个点下调表达,6个点上调表达(图3; 表1; 表2)。
.png) 图3 处理与对照的2倍差异点 注: a~e截取自图1边框部分; 图片中数字代表蛋白点 Figure 3 Differential proteins (|ratio|>2) identified in treatment and control Note: a~e taken from figure 1 of the frame part; The numbers in picture represent protein spots |
.png) 表1 下调表达的蛋白质 Table 1 Down-regulated proteins |
|
表2上调表达的蛋白质 Table 2 Up-regulated proteins |
1.2.2下调表达的蛋蛋白质功能分析
查询GO和KEGG数据库结果显示,下调的8个蛋白点主要涉及光合作用、ATP合酶、细胞骨架的动态组装和肽链延伸。
如3号蛋白点ATP合酶在生物体中非常保守,其delta链主要负责H离子的跨膜转运为ATP合成提供离子浓度差(Paino et al., 2011)。4号蛋白点,在大豆数据库中显示的是功能未知,但在GO数据库中同拟南芥序列比对,注释为叶绿体的光系统Ⅱ,负责捕光反应中光子的吸收和传递。
核酮糖l,5-二磷酸羧化酶/加氧酶(Rubisco)是植物叶蛋白的主要成分,在C3植物中其含量占可溶蛋白的50%,是地球上最丰富的蛋白质,通常由核酮糖l,5-二磷酸羧化酶/加氧酶由大亚基(LS)和小亚基(SS) 组成。10、11、15和17号四个蛋白点都是Rubisco相关酶类,其下调表达则预示着受玉米小斑病菌胁迫后的大豆光合效率下降(Pospíšil, 2012; Widjaja et al., 2009)。Leitao等(2007)发现,在臭氧胁迫下,随臭氧剂量增加,Rubisco和PEPc蛋白呈下降趋势。
12号蛋白点功能涉及翻译延伸因子。真核生物的翻译延伸因子是肽链合成的重要分子机制,它不仅调节蛋白质翻译,还参与许多重要的生物学过程,如生物或非生物胁迫应答、细胞骨架组成等(Lamberti et al., 2004; Franz et al., 2011; Negrutskii et al., 2012; Bielecki et al., 2012)。
细胞骨架是真核细胞的三大结构体系之一,在受病原菌侵染时无论是动物还是植物都会有细胞骨架的重排,包括骨架位置的移动、肌动蛋白纤维的聚合和解聚等(Cossart, 1997; Khokhlova et al., 2003; Takemoto et al., 2006)。18号蛋白点则负责肌动蛋白的聚合与解聚来调节细胞骨架结构和装配。而12和18号蛋白点下调是否纯属巧合,还是因细胞骨架应答胁迫时偶联了延伸因子的下调表达尚未可知。
1.2.3上调表达的蛋白质功能分析
1号(MW: 15.37 kD; pI为4.59)蛋白点也是负责肌动蛋白的聚合与解聚来调节细胞骨架结构和装配,是小分子量的偏酸性蛋白、呈上调表达。上调表达的蛋白还有2、13、14、16和8号,其中8号功能未知,而13、14和16号蛋白均是发育相关蛋白,分别与芳香族氨基酸代谢、叶绿体合成相关的20KD分子伴侣和内质网中蛋白质运输有关的分泌蛋白SEC13同源物。这些蛋白的上调表达都与生物应答胁迫的反应相关(Esquível et al., 2006; Heyndrickx and Vandepoele, 2012; Hyman and Jarvis, 2011; Kozubowski et al., 2011)
PR蛋白是植物病原微生物胁迫后诱导产生并积累的一类蛋白质总称,是植物防御反应的重要组成部分(Katilé et al., 2010)。根据其相似的氨基酸序列、酶活性或者其它分子功能,PR蛋白主要分为17个家族,从植物中衍生、并已经鉴定出其氨基酸序列的PR蛋白家族有第2、第3、第4、第5、第8和第10族。PR-10家族蛋白通常是由于病原微生物诱导而使植物产生防御反应相关的一类蛋白,对过敏人群有害,但对植物自身却是一种因抗病需要而产生的蛋白(Katilé et al., 2010)。近年来相关研究表明,PR-10蛋白一般为分子量16~19 kD的酸性蛋白,本研究所分离到的2号蛋白点PR-10类似蛋白分子量为(13.63/17.69)、等电点为(5.17/4.65),也符合此特征。
综上所述,在玉米小斑病菌的胁迫(Stress)下,大豆的光合作用、生长发育和能量代谢途径都有应答反应。从蛋白质上调、下调表达情况初步推测,大豆为应答玉米小斑病菌胁迫,通过抑制(或降低)光合作用、能量代谢途径相关蛋白表达,来提高(或增加)防御相关途径相关蛋白表达如病程相关蛋白PR-10的上调表达(图4)。
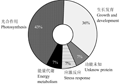 图4 差异蛋白功能分类趋势 Figure 4 Functional tendency of differential protein analysis |
2讨论
2.1序列相同而功能预测不同的差异蛋白质
1号与18号蛋白点具有相同的蛋白质序列号和功能预测,都是负责肌动蛋白的聚合与解聚来调节细胞骨架结构和装配(Profilin-2),但它们在2-DE胶上的位置却大相径庭:1号是小分子量的偏酸性蛋白、呈上调表达,在a框图位置,18号是近中性蛋白,呈下调表达,在e框图(图3和图1)。此种情况,可能是蛋白质的翻译后修饰或者同其他蛋白结合后以实现不同生理功能的结果。
蛋白质是有机体内各种功能和生理活动的执行者,但它不像基因呈稳定状态存在于生物体中,也不与mRNA一一对应。尽管基因序列决定了蛋白质的氨基酸序列,但蛋白质在行使功能时,可能受到3~5个过程的调控:① mRNA的转录水平调控,②翻译水平调控,③翻译后水平调控;此外,蛋白质还要沿细胞骨架运输到细胞中特定位置,可能要同其他分子结合才能被活化(如磷酸化和G蛋白偶联受体等) (何华勤, 2011)。因此,1号和18号蛋白质的氨基酸序列相同,但其结构、相对分子质量、等电点及其在2-D胶上分布的位置和上调、下调不一致也就不难理解了。
就说一个翻译后修饰过程:有机体的生长发育、免疫应答、细胞凋亡等都必须由翻译后、修饰好的蛋白质才能实现。蛋白质翻译后修饰是一个复杂和极其重要的过程,它调节着蛋白质的形态结构、物理和化学性质,从而可改变蛋白质的功能(Rhoads et al., 2013)。换言之,蛋白质在执行生物学过程时,完全可能被修饰成分子量或等电点异样的多种蛋白质,或翻译后修饰也是蛋白质功能多样化的主要原因之一(Theillet et al., 2012)。
目前在真核生物中20种以上的修饰类型,比较常见的是糖基化、乙酰化、泛素化和磷酸化等(Taylor et al., 2011; Theillet et al., 2012)。其中,如磷酸化常常是信号转导的开关作用,磷酸化后的蛋白质分子量几乎不改变,但pH会有改变。据此,经过3次重复、表达差异2倍以上和P值<0.05计算得到的1号蛋白点上调和18号蛋白质点下调,及其二者在2-D胶上的分布位置不同但氨基酸顺序相同,就不能简单理解为试验误差甚至错误,而正好可能是某蛋白质功能多样化的表现形式之一。
2.2表达倍数在1.5-2倍间的差异蛋白质
结合图1图3可知,表达差异点多数是在凝胶图上表达量不算最高的一些小蛋白点,而那些浓度高(染色深)、表达量大(胶点大)的蛋白点虽然也有上调、下调表达的情况,但其差异很难到2倍以上,所以未被选作质谱和生物信息学分析。原因可能是防御相关的差异表达蛋白是一些低丰度、小分子的蛋白。或者,提醒我在今后的研究中,可以挑取一些表达量绝对值大、有变化但不到2倍的差异点测序并分析,才能更准确地阐明应答机制。比如,也有研究者将表达1.5倍及以上(P值<0.05)的蛋白质送测序和功能分析,用于揭示抗逆或防御反应的分子机制(Cheng et al., 2009)。
2.3玉米小斑病菌胁迫可诱导大豆的非寄主抗性反应
本文的研究目的只有一个,明确在实验室条件下玉米小斑病菌落在矮杆作物大豆上,除了不发病外还能否诱导大豆的非寄主抗性反应,以期为后续的非寄主抗性利用研究奠定基础。在前期的胼胝质观察、H2O2观察、防御酶活性测定、防御基因转录水平表达研究的基础上,结合本蛋白质组学研究结果可初步推测,大豆能被玉米小斑病菌诱导产生非寄主抗性。
从蛋白质质谱和生物信息学分析结果可知,大豆可能以降低光合作用和能量代谢效率为代价来提高其防御相关的蛋白质表达。这与大豆接种自身致病菌(如病毒)的差异表达蛋白有相似的地方,也有不同之处。不同之处是,大豆的非寄主抗性表达蛋白涉及的生长发育过程中非常重要的生理功能,如光合作用、能量代谢、蛋白质延伸因子、细胞骨架重组等,是广谱的抗性反应,而致病相关反应的主要是一些R基因的差异表达。
如果该类非寄主抗性在多样性种植系统中可由非致病菌诱导产生,则可免去直接喷洒茉莉酸、水杨酸等化学试剂来诱导植物抗性。既可实现非寄主抗性的广谱抗病目的,还可节约生产成本和人力、物力,为农业的可持续发展和粮食安全做出应有的贡献。
3材料与方法
3.1植物材料
大豆品种华春6号(南京农业大学惠赠),播种于装有花卉基质的花盆(直径24 cm),每天12 h光照(25℃)/12 h黑暗(20℃)光照培养室生长,大豆长至两对真叶完全展开(3周龄左右),备用。
玉米小斑病菌(Bipolaris maydis) O小种94,由云南农业大学植物保护学院赵正龙分离、保存、惠赠。将菌株94接种于PDA培养基上,25℃、黑暗培养10 d,向培养皿中倒入适量无菌水(添加0.1%吐温20)。用药匙轻轻刮落孢子,经四层纱布过滤后,将孢子悬浮液浓度调至1.0×105个孢子/mL,喷雾接种于备好的大豆(华春6号)植株上,作为处理。同时取等量无菌水(添加0.1%吐温20)喷雾相同批次的大豆,作为对照。薄膜保湿,并置于暗室。
于接种后48 h取处理和对照的大豆叶片,于-80℃冰箱保存备用
3.2大豆叶片总蛋白提取及蛋白定量
3.2.1蛋白质提取
取1 g大豆叶片(3次重复)于冰预冷的研钵中,加入液氮研磨。参照苏源等(2011)方法,利用TCA/丙酮沉淀法提取大豆叶片总蛋白(余萍等, 2012)。只是80%丙酮洗涤沉淀时的离心参数调整为22 000 rpm,4℃,20 min。沉淀于超净工作台上自然风干,即获大豆叶片总蛋白质干粉。
3.2.2利用DNA回收过滤柱纯化蛋白质
以上蛋白干粉按30 mg每份称取,转入灭菌的DNA回收过滤柱中,再按1 mg (蛋白干粉)/15 μL加入水化液(450 μL),轻弹管壁让蛋白质充分溶解,室温静置1 h后,20 000 rpm,20℃,20 min离心后弃沉淀,将滤液转入2 mL灭菌离心管中。加入4倍体积-20℃预冷含1% DTT的丙酮(1.6 mL)颠倒混匀后于-20℃沉淀2 h,20 000 rpm,4℃,离心20 min,弃上清,蛋白质沉淀于超净工作台自然风干,至丙酮挥发完全为止即可用于双向电泳。
3.2.3电泳前的蛋白质浓度测定及定量
加入适量水化液将蛋白完全溶解至透明,用Bradford法测定蛋白质浓度为6 μg/μL。本研究所用IPG胶条为24 cm长度,所需上样量600 μg/500 μL,取100 μL浓度为6 μg/μL蛋白质即600 μg量,再加入水化液400 μL,即获每根IPG胶条的上样量为600 μg/500 μL。每个处理三次重复,在GE双向电泳系统中,一次跑完六块凝胶,消除了因操作引起的误差。
3.3双向电泳
3.3.1 IPG胶条溶胀(IPG胶条水化)
将3.2中调至600 μg/500 μL的蛋白质溶液于室温下,22 000 rpm,离心5 min。弃沉淀,取上清转入水化盘的小槽中。缓慢放入GE公司的IPG胶条(pH 4/7, 24 cm),于18℃~22℃充分溶胀16~24 h。
3.3.2 IEF和SDS-PAGE
在GE公司的聚焦仪上进行聚焦。其电压程序设定如下:S1,电压50 V,Slow,时间10 min;S2,电压250 V,Rapid,时间30 min;S3,电压1 000 V,Rapid,时间30 min;S4,电压9 000 V,Line,时间4.5 h;S5,电压9 000 V,Rapid,改成伏特小时(65 000)。检查其他参数:GELS:6;Limit:50;Temp:20℃。
聚焦好的胶条分别进行2次平衡操作。平衡液母液配方为:6 mol/L尿素,2% SDS,50 mmol/L pH 8.8 Tris-HCl,30%甘油和0.002%(m/v)溴酚蓝。第一次平衡时,向冻融的平衡母液中现加1%的DTT,每根胶条加此平衡液Ⅰ 10 mL,于摇床上缓慢摇晃、平衡15 min。第二次平衡时,向冻融的平衡母液中现加5%的IAA,将平衡管中的平衡液Ⅰ倾出,加入此平衡液Ⅱ 10 mL/根胶条,于摇床上缓慢摇晃、平衡15 min。
平衡好的IPG胶条蘸上电泳缓冲液,用两把镊子小心转入预制好的12.5%的凝胶上,在胶条的一端加入蛋白Mark (SM0431, Fermentas),用1%的低熔点琼脂糖封胶液固定好胶条(余萍等, 2012)。转入GE公司的蛋白双向电泳系统的垂直电泳槽,以恒电流进行电泳,开始电流为20 mA/块胶,溴酚蓝进入凝胶后改用40 mA/块胶电泳至结束。
凝胶的固定、染色和脱色参考苏源等(2011)方法,直至凝胶背景颜色脱净为止。
3.4凝胶图像的扫描和分析
脱色后的凝胶于GE公司的扫描仪(Image Scanner Ⅲ)上扫描,并获取凝胶图像。扫描时注意:图像大小均设置为300 dpi及以上,务必将需要的图像大小设置成大小完全一致,否则不利于PDQuest软件分析。
扫描后凝胶图像,利用软件PDQuest 7.4 (Biorad)进行分析,包括蛋白质点的检测和匹配,凝胶所能分离到的蛋白质分子量和等电点计算,分析并标注差异蛋白点等。3次重复中蛋白质差异表达量达2倍以上的蛋白质点视为差异点(苏源等, 2011; 余萍等, 2012)。
3.5胶点切割、质谱鉴定及蛋白质功能注释
将PDQuest 7.4软件分析后的差异点顺序编号,本研究中表达量达2倍以上差异的蛋白点共18个。用剪刀将灭菌后的1 mL、200 μL枪头剪至差异点大小,类似于打孔器,依次打孔取出18个差异蛋白点分别转入灭菌的1.5 mL离心管中,送上海中科新生命生物科技有限公司测序(串联质谱法, MS+MS/MS)。
将质谱仪获得的质谱峰数据通过Mascot程序(http://www.matrixscience.com/)进行蛋白质检索,检索的数据库为NCBInr (NCBI-National Center for biotechnology information non-redundant database)和大豆基因组数据库。
测序报告时,每个蛋白点通常提供相关的10条信息。选择蛋白质功能注释的条件为:① Protein Score C.I. %为100%;②匹配肽段数≥3;③氨基酸序列覆盖率>15%。将符合以上3点要求的蛋白质序列在Gene ontology数据库中(http://amigo.geneontology.org/cgi-bin/amigo/blast.cgi/)进行功能注释和分类(余萍等, 2012),再将相关蛋白质功能名称在PubMed-NCBI (http://www.ncbi.nlm.nih.gov/pubmed/)中查询相关文献进行蛋白质功能的进一步阐述和分析。
作者贡献
董玉梅,完成本试验的2-DE电泳及后期的数据分析,完成论文初稿。何霞红参与论文设计及试验材料准备,苏源完成植物蛋白质双向电泳方法建立和后期的数据分析部分工作,肖秋芸参与双向电泳部分试验,赵正龙分离并纯化玉米小斑病菌。李成云,朱有勇提出试验方案,并指导整个试验过程。朱有勇修改论文并定稿。全体作者已阅读并同意最终稿件。
致谢
本研究由国家973计划(2011CB100400)资助。
参考文献
Bielecki P., Lukat P., Hüsecken K., Dötsch A., Steinmetz H., Hartmann R.W., Müller R., and Häussler S., 2012, Mutation in elongation factor G confers resistance to the antibiotic argyrin in the opportunistic pathogen Pseudomonas aeruginosa, Chembiochem, 13(16): 2339-2345
Cameron D.D., Coats A.M., and Seel W.E., 2006, Differential resistance among host and non-host species underlies the variable success of the hemi-parasitic plant rhinanthus minor, Ann. Bot., 98(6): 1289-1299
Cheng Z., Wei Y.Y., Sung W.W., Glick B.R., and McConkey B.J., 2009, Proteomic analysis of the response of the plant growth-promoting bacterium Pseudomonas putida UW4 to nickel stress, Proteome Sci., 7: 18
Cossart P., 1997, Host/pathogen interactions. subversion of the mammalian cell cytoskeleton by invasive bacteria, J. Clin. Invest., 99(10): 2307-2311
Daxberger A., Nemak A., Mithöfer A., Fliegmann J., Ligterink W., Hirt H., and Ebel J., 2007, Activation of members of a MAPK module in beta-glucan elicitor-mediated non-host resistance of soybean, Planta, 225(6): 1559-1571
Dong Y.M., Pan M.H., Zhao Z.L., Yang M., and He X.H., 2013, Callose deposition in the leaf cells associated with induced resistance of Glycine max to Bipolaris maydis, Yunnan Nongye Daxue (Journal of Yunnan Agricultural University), 28(1): 16-20 (董玉梅, 潘满华, 赵正龙, 杨敏, 何霞红, 2013, 玉米小斑病菌诱导大豆叶片胼胝质沉积的初步研究, 云南农业大学学报, 28(1): 16-20)
Esquível M.G., Pinto T.S., Marín-Navarro J., and Moreno J., 2006, Substitution of tyrosine residues at the aromatic cluster around the betaA-betaB loop of rubisco small subunit affects the structural stability of the enzyme and the in vivo degradation under stress conditions, Biochemistry, 45(18): 5745-5753
Franz S., Ehlert B., Liese A., Kurth J., Cazalé A.C., and Romeis T., 2011, Calcium-dependent protein kinase CPK21 functions in abiotic stress response in Arabidopsis thaliana, Mol. Plant, 4(1): 83-96
He H.Q., ed., 2011, Concise proteomics, China Forestry Publishing House, Beijing, China, pp.1-10 (何华勤, 2011, 简明蛋白质组学, 中国林业出版社, 中国, 北京, pp.1-10)
Heath M.C., 2000, Nonhost resistance and nonspecific plant defenses, Curr. Opin. Plant Biol., 3(4): 315-319
Heyndrickx K.S., and Vandepoele K., 2012, Systematic identification of functional plant modules through the integration of complementary data sources, Plant Physiol., 159(3): 884-901
Hyman S., and Jarvis R.P., 2011, Studying Arabidopsis chloroplast structural organisation using transmission electron microscopy, Methods Mol. Biol., 774: 113-132
Jones J.D., and Dangl J.L., 2006, The plant immune system, Nature, 444(7117): 323-329
Katilé S.O., Perumal R., Rooney W.L., Prom L.K., and Magill CW., 2010, Expression of pathogenesis-related protein PR-10 in sorghum floral tissues in response to inoculation with Fusarium thapsinum and Curvularia lunata, Mol. Plant Pathol., 11(1): 93-103
Khokhlova L.P., Olinevich O.V., and Raudaskoski M., 2003, Reorganization of the microtubule and actin cytoskeleton in root cells of Triticum aestivum L. during low temperature and abscisic acid treatments, Cell Biol. Int., 27(3): 211-212
Kozubowski L., Thompson J.W., Cardenas M.E., Moseley M.A., and Heitman J., 2011, Association of calcineurin with the COPI protein Sec28 and the COPII protein Sec13 revealed by quantitative proteomics, PLoS One, 6(10): e25280
Lamberti A., Caraglia M., Longo O., Marra M., Abbruzzese A., and Arcari P., 2004, The translation elongation factor 1A in tumorigenesis, signal transduction and apoptosis: review article, Amino Acids, 26(4): 443-448
Leitao L., Maoret J.J., and Biolley J.P., 2007, Changes in PEP carboxylase, rubisco and rubisco activase mRNA levels from maize (Zea mays) exposed to a chronic ozone stress, Biol. Res., 40(2): 137-153
Li C., He X., Zhu S., Zhou H., Wang Y., Li Y., Yang J., Fan J., Yang J., Wang G., Long Y., Xu J., Tang Y., Zhao G., Yang J., Liu L., Sun Y., Xie Y., Wang H., and Zhu Y., 2009, Crop diversity for yield increase, PLoS One, 4(11): e8049
Negrutskii B., Vlasenko D., and El'skaya A., 2012, From global phosphoproteomics to individual proteins: the case of translation elongation factor eEF1A, Expert. Rev. Proteomics, 9(1): 71-83
Paino A., Tuominen H., Jääskeläinen M., Alanko J., Nuutila J., Asikainen S.E., Pelliniemi L.J., Pöllänen M.T., Chen C., and Ihalin R., 2011, Trimeric form of intracellular ATP synthase subunit β of Aggregatibacter actinomycetemcomitans binds human interleukin-1β, PLoS One, 6(4): e18929
Pan M.H., 2012, Nonhost resistant response of Glycine max to Bipolaris maydis, Thesis for M.S., Yunnan Agricultural University, Supervisor: Li C.Y., pp.25-39 (潘满华, 2012, 大豆对玉米小斑病菌非寄主抗性响应的研究, 硕士学位论文, 云南农业大学, 导师: 李成云, pp.25-39)
Pospíšil P., 2012, Molecular mechanisms of production and scavenging of reactive oxygen species by photosystemⅡ, Biochim. Biophys. Acta, 1817(1): 218-231
Rhoads T.W., Williams J.R., Lopez N.I., Morré J.T, Bradford C.S., and Beckman J.S., 2013, Using theoretical protein isotopic distributions to parse small-mass-difference post-translational modifications via mass spectrometry, J. Am. Soc. Mass. Spectrom., 24(1): 115-124
Shimada C., Lipka V., O'Connell R., Okuno T., Schulze-Lefert P., and Takano Y., 2006, Nonhost resistance in Arabidopsiscolletotrichum interactions acts at the cell periphery and requires actin filament function, Mol. Plant Microbe Interact., 19(3): 270-279
Shukla O.P., Singh P.K., and Deshbhratar P.B., 2010, Impact of phosphorous on biochemical changes in Hordeum vulgare L. in mixed cropping with chickpea, J. Environ. Biol., 31(5): 575-580
Sobhanian H., Razavizadeh R., Nanjo Y., Ehsanpour A.A., Jazii F.R., Motamed N., and Komatsu S., 2010, Proteome analysis of soybean leaves, hypocotyls and roots under salt stress, Proteome Sci., 8: 19
Su Y., Yu P., Kong C.S., Cai Y.Y. , Yang J., Liu L., and Li C.Y., 2011, Preliminary study of the total proteins of roots, stems and leaves in wheat, seedling using two-dimensional electrophoresis, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding (online)), 9: 1366-1372 (苏源, 余萍, 孔垂思, 蔡翌阳, 杨静, 刘林, 李成云, 2011, 小麦幼苗根、茎和叶蛋白质双向电泳的初步研究, 分子植物育种(online), 9: 1366-1372)
Takemoto D., Jones D.A., and Hardham A.R., 2006, Re-organization of the cytoskeleton and endoplasmic reticulum in the Arabidopsis pen1-1 mutant inoculated with the non-adapted powdery mildew pathogen, Blumeria graminis f. sp. hordei, Mol. Plant Pathol., 7(6): 553-563
Taylor N.L., Heazlewood J.L., and Millar A.H., 2011, The Arabidopsis thaliana 2-D gel mitochondrial proteome: refining the value of reference maps for assessing protein abundance, contaminants and post-translational modifications, Proteom- ics, 11(9): 1720-1733
Theillet F.X., Smet-Nocca C., Liokatis S., Thongwichian R., Kosten J., Yoon M.K., Kriwacki R.W., Landrieu I., Lippens G., and Selenko P., 2012, Cell signaling, post-translational protein modifications and NMR spectroscopy, J. Biomol. NMR, 54(3): 217-236
Tiffin P., and Moeller D.A., 2006, Molecular evolution of plant immune system genes, Trends Genet., 22(12): 662-670
Widjaja I., Naumann K., Roth U., Wolf N., Mackey D., Dangl J.L., Scheel D., and Lee J., 2009, Combining subproteome enrichment and rubisco depletion enables identification of low abundance proteins differentially regulated during plant defense, Proteomics, 9(1): 138-147
Yu P., Su Y., Kong C.S., Yang J., Liu L., and Li C.Y., 2012, Comparative proteomic analysis of seed leaf proteins in rice landrace acuce and Lijiangxintuanheigu using two-dimensional electrophoresis, Yunnan Nongye Daxue Xuebao (Jou- rnal of Yunnan Agricultural University), 27(4): 475-482 (余萍, 苏源, 孔垂思, 杨静, 刘林, 李成云, 2012, 水稻地方品种月亮谷与LTH叶片蛋白质的双向电泳分析, 云南农业大学学报, 27(4): 475-482)
Yun B.W., Atkinson H.A., Gaborit C., Greenland A., Read N.D., Pallas J.A., and Loake G.J., 2003, Loss of actin cytoskeletal function and EDS1 activity, in combination, severely compromises non-host resistance in Arabidopsis against wheat powdery mildew, Plant J., 34(6): 768-777
Zhu Y., Chen H., Fan J., Wang Y., Li Y., Chen J., Fan J., Yang S., Hu L., Leung H., Mew T.W., Teng P.S., Wang Z., and Mundt C.C., 2000, Genetic diversity and disease control in rice, Nature, 406(6797): 718-722