2 西南科技大学生命科学与工程学院, 绵阳, 621010;
3 中国农业科学研究院生物技术研究所, 北京, 100081
 作者
作者  通讯作者
通讯作者
豆科基因组学与遗传学, 2012 年, 第 3 卷, 第 2 篇
收稿日期: 2012年03月01日 接受日期: 2012年03月01日 发表日期: 2012年03月01日
杜世章等, 2012, 不同浓度NaCl胁迫处理下豇豆幼苗抗氧化酶活性的变化, 豆科基因组学与遗传学(online), 3(2):8-13 (doi: 10.5376/mpb.cn.2012.03.0002)
引用格式(英文):
Du et al., 2014, Changes of Antioxidant Enzymes Activities in Cowpea (Vigna unguiculata Linn.) Seedlings under Different Concentrative NaCl Stress, DoukeJiyinzuxue Yu Yichuanxue (online) (Legume Genomics and Genetics), 3(2): 8-13 (doi: 10.5376/mpb.cn.2012.03.0002)
本研究主要探讨不同浓度 NaCl 胁迫处理下豇豆(Vigna unguiculata Linn.)幼苗叶片抗氧化酶活性的 变化情况。研究结果表明,在 0~250 mmol/L NaCl 胁迫下,随着盐浓度的增加,豇豆幼苗叶片可溶性蛋白质、 脯氨酸和丙二醛含量逐渐增加,在 150 mmol/L 浓度时,3 者的含量都达到最大值;而超氧化物歧化酶(SOD)、 过氧化物酶(POD)和过氧化氢酶(CAT)的活性开始逐渐上升,它们的活性分别在 100 mmol/L、150 mmol/L 和 150 mmol/L 时达到最大值,然后逐渐下降。同时,对 NaCl 胁迫下 3 种抗氧化酶基因的表达进行适时定量 PCR 分析,分析结果显示 3 种抗氧化酶基因的转录表达与酶活性的变化一致。说明在不同浓度的 NaCl 胁迫 下,NaCl 诱导了 sod、pod 和 cat 3 种抗氧化酶基因的表达,3 种抗氧化酶活性相应地提高,从而提高了豇豆应 对 NaCl 胁迫的能力。本文结果将为今后豇豆在盐碱栽培生产提供一定的参考。
NaCl等盐胁迫是限制作物产量的一个重要因子,因为NaCl等盐胁迫几乎影响了植物所有的代谢功能(Bohnert and Jensen, 1996),如光合作用受抑制,质膜流动性受到影响及细胞内活性氧和代谢毒物(如丙二醛)积累增多等(Hasegawa et al., 2000)。在NaCl等盐胁迫下,甘蓝型油菜体内的含水量逐渐下降,质膜流动性增大,电解质渗出率增加(代其林等, 2009)。在盐等逆境胁迫下,植物体内还会产生活性氧(reactive oxygen species, ROS) (Mittler, 2006; Kavitha et al., 2008)。微量的活性氧可以作为一种信号分子传递到植物的其它部位(Apel and Hirt, 2004; Mittler, 2002),产生 一系列的代谢变化;而大量活性氧使植物体内处于氧化胁迫(Gossett et al., 1996; Gómez et al., 1999; Savouré et al., 1999),甚至会严重地破坏植物细胞内的平衡和正常代谢,使其体内的生物大分子物质受到氧化损伤,如 脂类、核酸和蛋白质损伤等(Baxter et al., 2007)。
为了应对和适应非生物氧化胁迫环境,植物调 动一系列的分子反应体系,维持其自身的正常生理状态(Baxter et al., 2007)。植物通过其抗氧化酶体系 清除活性氧自由基,达到避免受氧化损伤的目的 (Asada, 1999)。而参与活性氧代谢的酶类主要有超氧 化歧化酶(SOD)、过 氧化氢酶(CAT) 和过氧化物酶 (POD)等。甘蓝型油菜在 200 mmol/L NaCl 胁迫下, POD、SOD 和 CAT 的酶基因的表达及其酶活性均显 著提高(代其林等, 2009)。同时,植物细胞还积累一些 小分子可溶性渗透调节物质(Hare and Cress, 1997; Jain and Selvaraj, 1997; Nelson et al., 1998; Bohnert and Shen, 1999; Hasegawa et al., 2000)来维持细胞的 膨胀状态(Hernández et al., 2001)及丙二醛(MDA)和 脯氨酸(Pro)含量的增加(Zhu, 2002)。
豇豆(Vigna unguiculata Linn.)属于豆科豇豆属, 是我国重要的蔬菜作物,在整个生长发育期对盐胁 迫都很敏感。本实验中我们选取豇豆作为研究对象, 考察不同浓度 NaCl 胁迫处理下豇豆幼苗叶片抗氧 化酶活性的变化,同时也测定了丙二醛(MDA)和脯氨 酸(Pro)含量的变化,初步探索了豇豆幼苗叶片 3 种抗 氧化酶基因在不同盐浓度下基因表达水平的变化,以 期为今后豇豆在盐碱地栽培生产提供一定的参考。
1 结果与分析
1.1 NaCl胁迫下豇豆幼苗叶片中总可溶性蛋白含量 的变化
可溶性蛋白参与植物细胞渗透势的调节,较高质量分数的可溶性蛋白质,有利于植物细胞维持较低的 渗透势,抵御盐胁迫带来的伤害(Kavitha et al., 2008)。 在不同浓度 NaCl 胁迫 12 h 后,随着盐胁迫浓度的增 加,可溶性蛋白含量逐渐增加(图1),在 150 mmol/L NaCl 时最高,为 821.32 mg/g DW,随后又逐渐下降。
.png) 图1 NaCl 胁迫下豇豆幼苗叶片可溶性蛋白含量的变化
注: DW: 干重
Figure 1 Changes of the content of soluble protein from leaves of cowpea seedlings under NaCl stress
Note: DW: Dry weight
|
1.2 NaCl胁迫下豇豆幼苗叶片中丙二醛(MDA)含量 的变化
豇豆幼苗在经0~250 mmol/L NaCl 胁迫 12 h后,豇豆叶片的丙二醛含量均升高(图2)。随着NaCl浓度的增加,豇豆幼苗叶片丙二醛含量也逐渐增加,在150 mmol/L NaCl 时,豇豆幼苗叶片丙二醛含量最 高,然后逐渐下降,但都比没有用 NaCl 处理的幼苗 叶片丙二醛含量高。表明在NaCl胁迫下,豇豆幼苗叶片通过提高丙二醛含量来抵御外界胁迫的影响。
.png) 图2 NaCl 胁迫下豇豆幼苗叶片丙二醛含量的变化
注: DW: 干重
Figure 2 Changes of the content of MDA from leaves of cowpea seedlings under NaCl stress
Note: DW: Dry weight
|
1.3 NaCl胁迫下豇豆叶片中脯氨酸(Pro)含量的变化
植物中游离脯氨酸具有较强的渗透调节能力及保护细胞膜结构稳定的作用(汤章诚, 1984, 植物生理 学通讯, 1(1): 15-21)。在不同浓度的NaCl胁迫下,豇豆幼苗叶片的脯氨酸含量逐渐上升,在150 mmol/L NaCl 时达到最大值,然后逐渐下降(图3)。说明豇豆受到NaCl胁迫时,能够通过增加脯氨酸含量来提高 细胞渗透势,从而提高豇豆抗性。
.png) 图3 NaCl 胁迫下豇豆幼苗叶片脯氨酸含量的变化
注: DW: 干重
Figure 3 Changes of the content of proline from leaves of cowpea seedlings under NaCl stress
Note: DW: Dry weight
|
1.4 NaCl 胁迫下豇豆叶片抗氧化酶活性的变化
在非生物胁迫下,SOD、POD和CAT等酶系是植物体内抗氧化防御体系中最重要的保护酶类。在 不同浓度NaCl胁迫下,豇豆叶片中POD、SOD和CAT等酶系活性都不断增加(图4; 图5; 图6),其中SOD酶活性在100 mmol/L 浓度时达最大,而 POD和CAT等酶系活性在150 mmol/L时达最大,然后又逐渐下降。说明在不同浓度的盐胁迫过程中,植物 体内不同的抗氧化酶不是同步起作用的。
 图4 NaCl 胁迫下豇豆幼苗叶片POD 酶活性的变化
注: U: 酶活力单位
Figure 4 Changes of the activity of POD from leaves of cowpea seedlings under NaCl stress
Note: U: Unit of the enzyme activity
|
 图5 NaCl 胁迫下豇豆幼苗叶片SOD 酶活性的变化
注: U: 酶活力单位
Figure 5 Changes of the activity of SOD from leaves of cowpea seedlings under NaCl stress
Note: U: Unit of the enzyme activity
|
 图6 NaCl 胁迫下豇豆幼苗叶片CAT 酶活性的变化
注: U: 酶活力单位
Figure 6 Changes of the activity of CAT from leaves of cowpea seedlings under NaCl stress
Note: U: Unit of the enzyme activity
|
1.5 NaCl 胁迫下豇豆叶片中抗氧化酶基因相对表达 的变化
在不同浓度(0 mmol/L, 50 mmol/L, 100 mmol/L, 150 mmol/L, 200 mmol/L 和 250 mmol/L)的NaCl胁迫12 h后,豇豆幼苗叶片pod、sod和cat酶基因的表达水平存在差异。其中没有用盐处理的3种抗氧化酶基因有少量表达;在50~250 mmol/L NaCl胁迫下,豇豆幼苗叶片的sod、pod和cat等抗氧化酶基因的相对表达水平都不同程度提高,其中pod和sod基因在150 mmol/L NaCl浓度下达最大表达水平,而cat基 因在100 mmol/L NaCl浓度下达到最大表达水平,然后三者的表达量都开始下降(图 7)。
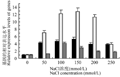 图7 NaCl 胁迫下豇豆幼苗叶片sod, pod 和cat 基因表达的变化
Figure 7 Changes of the relative expression of sod, pod and cat genes from leaves of cowpea seedlings under NaCl stress
|
2 讨论
植物在 NaCl 等盐害胁迫时,其生理特性发生巨大的变化。植物光合作用的过多光合电子传递到分子O2 的比例相对增加,可使体内活性氧含量大量增加(汤章诚, 1984, 植物生理学通讯, 1(1): 15-21),过量的活性氧对植物产生严重的氧化伤害,SOD、POD和CAT是清除活性氧过程中最重要的3种酶类。其中超氧化自由基被 SOD催化发生歧化反应生成O2 和H2O2,而产生的H2O2 再由POD和CAT分解(余叔文和汤章城, 2003),从而减轻NaCl等胁迫。脯氨酸与可溶性蛋白是植物体内普遍存在的物质,在逆境条件下,二者通过参与体内的某种代谢活动对植物进行保护性的调节,以增强抗逆性(汤章诚, 1984, 植物 生理学通讯, 1(1): 15-21)。脯氨酸与盐胁迫也密切相关,脯氨酸积累是植物体抵抗渗透胁迫的有效方式之一。脯氨酸的增高能够降低叶片细胞的渗透势,防止细胞脱水;而且脯氨酸具有很高的水溶性,可以保 护细胞膜系统,维持细胞内酶的结构,减少细胞内蛋白质的降解。大量研究表明,许多植物在盐胁迫下脯 氨酸迅速积累,耐盐植物中的脯氨酸含量高于不耐盐植物(汤章诚, 1984, 植物生理学通讯, 1(1): 15-21; 余叔文和汤章城, 2003)。MDA是膜脂过氧化作用的 最终产物,其含量的高低是膜脂过氧化程度的重要标志(汤章诚, 1984, 植物生理学通讯, 1(1): 15-21)。
本研究结果显示盐胁迫下豇豆幼苗叶片中3种 抗氧化酶的活性与植物抗氧化胁迫能力相关联,它们的活性高低可作为衡量植物抗逆性强弱的重要指标。由图4、图5和图6可知,豇豆幼苗在受到不同浓度的盐胁迫时,其SOD、POD和CAT酶活性都增加了,随着盐浓度增加,其酶活性都逐渐增加,SOD在 100 mmol/L时活性最高,POD和CAT在150 mmol/L活性最高,他们分别达到32.64 U·mg-1 protein·min-1、59.43 U·mg-1 protein·min-1、129.56 U·mg-1 protein·min-1,比没有用盐处理的酶活分别增加了0.31倍、0.63倍 和1.04倍。尽管盐胁迫使SOD、POD 和 CAT酶活性 都有所提高,但盐胁迫使细胞质膜处于氧化状态而受到损害,所以随着盐浓度的增加,脯氨酸和MDA含量增加,质膜受损伤程度也逐渐加重。盐胁迫下豇豆幼苗叶片抗氧化物酶基因的表达都发生了变化(图 7),在没有NaCl处理时豇豆叶片pod、sod和 cat基因都有微量表达,在不同浓度的盐胁迫下,3种抗氧化酶基因表达都增加。其中cat在100 mmol/L,pod和sod在150 mmol/L NaCl诱导后,它们的基因 表达量都达到最高,然后均下降,与相应酶的活性变化基本一致,这与甘蓝型油菜在盐胁迫下基因表达与酶活性的变化情况一致(代其林等, 2009)。这说明这3个抗氧化酶基因都是诱导型表达的基因,只要存在盐胁迫,它们均过量表达。
由本研究可知,一定程度的盐胁迫可诱导豇豆叶片中抗氧化酶活性的升高,这些酶有可能协同作 用共同抵抗盐胁迫造成的氧化伤害,但这种诱导作 用并非是无限的,重度胁迫可能对植物造成不可逆的伤害。我们推测严重盐胁迫对豇豆造成了一种不可逆伤害,但具体机制还有待于进一步研究证实。
3材料与方法
3.1供试材料
本实验所用豇豆品种为“翠宝198豇豆”,购自江西丰城市洪鑫种业有限公司。该品种抗病特性强、特耐高温,具有分枝多,肉质脆嫩、爽甜及纤维少、不易老化等特点。
3.2种子预处理
将豇豆种子用1%的 NaClO 溶液浸泡 10 min, 流水冲洗3~5次后吸胀12 h,于 25℃的光照培养箱中萌发24 h,再用蒸馏水清洗萌发的种子2~3 次。将萌发一致的种子播种在已灭菌石英砂中,浇上MS营养液,置于人工培养室(25±1)℃培养,每天补充水2次。待所有幼苗的第一对真叶全部展开时,选取长势一致的幼苗,分成5组,每组重复3次,每组分别用含0 mmol/L、50 mmol/L、100 mmol/L、150 mmol/L、200 mmol/L和250 mmol/L NaCl的MS培养液对其进行盐胁迫处理,处理时间12 h。然后取其叶为实验 材料,每次实验均重复3次,取其平均值。
3.3叶片酶粗液的提取
称取约 0.5 g 左右叶片组织于预冷的研钵中,加少量石英砂,2 mL (0.1 mol/L pH 6.8)的Tris-HCl 缓冲液,在冰浴中研磨成匀浆,用2 mL 缓冲液冲洗研钵,并将冲洗液也转至离心管中,在4℃下,4 000 r/min 离心20 min。将离心管的上清液分装于多个 1.5 mL离心管中,储存于-80℃冰箱中。
3.4丙二醛含量的测定
丙二醛含量的测定采用硫代巴比妥酸(TBA)比色法(李合生, 2000)。
3.5 脯氨酸含量测定
脯氨酸含量用茚三酮法测定(李合生, 2000)。
3.6 几种抗氧化酶的活性测定
用NBT光还原法测定超氧化物歧化酶(SOD)的活性(邵从本等, 1983, 植物生理学通讯, 5: 46-49)。按Omran (1980)的方法测定过氧化物酶(POD)的活性。而过氧化氢酶(CAT)活性按Beers和Sizer (1952)的方法进行。
3.7 抗氧化酶基因的相对表达
用无DNA的RNA提取试剂盒(上海华瞬生物 技术有限公司, W6711)提取豇豆幼苗叶片总RNA,然后把总RNA反转录合成第一链cDNA(reverse-tra- nscription Kit, Takara, Japan)。用IQ5 Real-time PCR仪(Bio-Rad),根据Two-step QuantiTect SYBR Green PCR Kit实验指南对pod、sod和cat基因进行定量扩增,用iCycler 定量分析软件(iCycler real-time detecti- on system software, version 2.0)分析基因的定量扩增数据。所有的实时定量 PCR 扩增都重复3 次实验。
作者贡献
本研究由王劲设计和指导,实验部分主要由杜世章、代其林、奉斌、谢琳和杨娟完成。
Apel K., and Hirt H., 2004, Reactive oxygen species: Metabolism, oxidativestress, and signal transduction, Annu. Rev. Plant Biol., 55: 373-399
Asada K., 1999, The water cycle in chloroplasts: Scavenging of active oxygen and dissipation of excess photons, Annu. Rev. Plant Physiol. Plant Mol. Biol., 50: 601-639
Baxter C.J., Redestig H., Schauer N., Repsilber D., Patil K.R., Nielsen J., Selbig J., Liu J., Fernie A.R., and Sweetlove L.J., 2007, The metabolic response of heterotrophic Arabidopsis cells to oxidative stress, Plant Physiology, 143(1): 312-325
Beers R.F. Jr., and Sizer I.W., 1952, Aspectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase, J. Biol. Chem., 195(1): 133-140
Bohnert H.J., and Jensen R.G., 1996, Metabolic engineering for increased salt tolerance, Australian Journal of Plant Physiol- ogy, 23(5): 661-667
Bohnert H.J., and Shen B., 1999, Transformation and compatible solutes, Scientia Hortic., 78(1-4): 237-260
Dai Q.L., Feng B., Liu T.T., Tian X., Gong Y.Y., Sun Y.K., Wang J., and Du S.Z., 2009, Antioxidant responses to NaCl stress in Brassica rapeseed seedlings, Jiyinzuxue Yu Ying- yong Shengwuxue (Genomics and Applied Biology), 28(4): 725-729 (代其林, 奉斌, 刘婷婷, 田霞, 龚元亚, 孙英坤, 王劲, 杜世章, 2009, 甘蓝型油菜幼苗对 NaCl 胁迫的抗氧化 应答, 基因组学与应用生物学, 28(4): 725-729)
Gómez J.M., Hernández J.A., Jiménez A., del Río L.A., and Sevill F., 1999, Differential response of antioxidative en- zymes of chloroplasts and mitochondria to long-term NaCl stress of pea plants, Free Radic. Res., 31: S11-S18
Gossett D.R., Banks S.W., Millhollon E.P., and Lucas M.C., 1996, Antioxidant response to NaCl stress in a control and an NaCl-tolerant cotton cell line grown in the presence of paraquat, butlionine sulfoximine, and exogenous glutathione, Plant Physiol., 112(2): 803-809
Hare P.D., and Cress W.A., 1997, Metabolic implications of stress-induced praline accumulation in plants, Plant Growth Regul., 21(2): 79-102
Hasegawa P.M., Bressan R.A., Zhu J.K., and Bohnert H.J., 2000, Plant cellular and molecular responses to high salinity, An- nu. Rev. Plant Physiol. Plant Mol. Biol., 51: 463-499
Hernández J.A., Ferrer M.A., Jiménez A., Barceló A.R., and Sevilla F., 2001, Antioxidant systems and O2.-/H2O2 produc- tion in the apoplast of pea leaves. Its relation with salt-in- duced necrotic lesions in minor veins, Plant Physiology, 127 (3): 817-831
Jain R.K., and Selvaraj G., 1997, Molecular genetic improvement of salt tolerance in plants, Biotech. Annu. Rev., 3: 245-267
Kavitha K., Venkataraman G., and Parida A., 2008, An oxidative and salinity stress induced peroxisomal ascorbate peroxi- dase from Avicennia marina: Molecular and functional character ization, Plant Physiology and Biochemistry, 46 (8-9): 794-804
Li H.S., ed., 2000, The physiological and biochemical principles and technology in plant, Higher Education Press, Beijing, China, pp.258-261 (李合生, 主编, 2000, 植物生理生化实 验原理和技术, 高等教育出版社, 中国, 北京, pp.258-261)
Mittler R., 2002, Oxidative stress, antioxidants and stresss tolerance, Trends Plant Sci., 7: 405-410
Mittler R., 2006, Abiotic stress, the field environment and stress combination, Trends Plant Sci., 11(1): 15-19
Nelson D.E., Shen B., and Bohnert H.J., 1998, Salinity toler- ance-mechanisms, models, and the metabolic engineering of complex traits, In: Setlow J.K., ed., Genetic engineering, Vol.20, Plenum Press, New York, USA, pp.153-176
Omran R.G., 1980, Peroxide levels and activities of catalase, peroxidase and indoleacetic acid oxidase during and after chill- ing cucumber seedlings, Plant Physiol., 65(2): 407-408
Savouré A., Thorin D., Davey M., Hua X.J., Mauro S., van Montagu M., Inzé D., and Verbruggen N., 1999, NaCl and CuZn- SO4 treatments trigger distinct oxidative defense mechanism in Nicotiana plumbaginifolia L., Plant Cell Environ., 22: 387-396
Yu S.W., and Tang Z.C., eds., 2003, Plant physiology and molecular biology, the 2nd edition, Science Press, Beijing, China, pp.739-749 (余叔文, 汤章城, 编著, 2003, 植物生理与分 子生物学, 第二版, 科学出版社, 中国, 北京, pp.739-749)
Zhu J.K., 2002, Salt and drought stress signal transduction plants, Annu. Rev. Plant Biol., 53: 247-273