2.贵州省旱粮研究所, 贵阳, 550006
3.贵州省农业生物技术重点实验室, 贵阳, 550006
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 30 篇 doi: 10.5376/mpb.cn.2011.09.0030
收稿日期: 2010年11月08日 接受日期: 2011年01月28日 发表日期: 2011年03月18日
何建文等, 2011, 48个辣椒地方品种SSR和SRAP标记的遗传多样性和指纹分析, 分子植物育种 Vol.9 No.30 (doi: 10.5376/mpb.cn.2011.09.0030)
为了评估辣椒地方法种质资源的遗传多样性和保护其知识产权,本研究以48个辣椒地方品种为试材,采用SSR和SRAP标记技术,进行分子标记多态性和聚类分析并构建数字化指纹图谱。结果如下:1、遵义朝天椒和J1羊角型椒两品种间,75个SSR标记中有15个SSR位点具有多态性;SRAP标记的30对PCR引物组合中,有11对引物组合的PCR扩增位点具有多态性。在48个品种中,15个SSR标记平均可检测2.7个等位基因,平均多态信息量(PIC)为0.54;11个SRAP标记(对应于SRAP的11对PCR引物组合)平均可检测16个等位基因,平均PIC为0.85。可见,所研究的地方品种具有较丰富的遗传多样性。2、经聚类分析,48个品种基于SSR标记可被分为6类,基于SRAP标记可被分为7类,基于SSR+SRAP标记可被分为5类。分类结果与果实形状有一定的关联,而且基于SSR+SRAP标记的分类更切合实际。3、构建的48个品种15个SSR标记和11个SRAP标记的数字化指纹图谱,出现完全相同指纹的概率非常低,可用于知识产权保护和品种鉴定。经用聚类分析筛选,只需选择CA514272、Hpms2-21、 Hpms1-69、 CA516439、 Hpms1-139和 BM61910等6个SSR标记,或者me1+em7和me2+em8两个SRAP标记即可鉴定参试品种。研究结果对于辣椒种质资源的遗传改良、育种实践、知识产权保护和品种鉴定具有实际意义。
种质资源即遗传资源,它是具有一定种质或基因并能繁殖的生物类型,包括地方品种、新培育的品种、重要的遗传材料以及野生近缘植物。地球上约有30万种植物,每种植物都蕴藏着丰富多样的基因资源。种质资源遗传多样性越丰富,即所含的基因变异越丰富,其对环境变化的适应能力就越强,进化的潜力就越大,选择的机会就越多。丰富的种质资源是农作物育种新基因源的重要来源之一,种质资源间的遗传差异是开展遗传育种的重要物质基础,高产、优质、多抗新品种的选育,取决于遗传资源合理、有效的开发利用和育种材料的精心选择和合理搭配。
辣椒原产中南美洲,又名番椒、海椒、辣子、辣茄等,属茄科辣椒属。它既是我国重要的蔬菜作物,又是人们日常生活中重要的调味品之一。我国现有的辣椒资源主要属于一年生辣椒(Capsicum annuum) (李曙轩, 1986),根据果实生长习性可以分为长椒(var. 1ongum)、灯笼椒(Var. grossum)、圆锥椒(var. conoides)、樱桃椒(var. cerasiforme)和簇生椒(var. fascicutatum) (Pickersgill, 1997) 5个变种。我国辣椒栽培历史悠久,类型多种多样,有较为丰富的地方资源。以往对辣椒种质资源的研究和评价,主要是针对形态特征及农艺性状的一些简单鉴定与描述,由于受种植环境等的影响,其评价具有一定的局限性。
近些年,随着分子生物学的不断发展,利用分子标记技术,可以在从分子水平上研究种质资源的起源、进化和遗传多样性等。用于农作物遗传多样性分析和指纹图谱构建的DNA分子标记方法,主要有RFLP、RAPD、SRAP、AFLP和SSR,等等。其中,SSR标记具有对DNA的质量和数量要求不高、操作简单、多态性好、重复性好等优点,SRAP标记具有操作简便、多态性丰富、重复性较好以及不需预知物种序列信息等优点。二者被广泛应用于水稻等多种农作物遗传多样性和指纹图谱构建的研究(张彦等, 2006; 赵丽萍等, 2007; 金梦阳等, 2006; 文雁成等, 2006)。在辣椒方面,Kwon等(2005)用27个SSR标记将66个辣椒品种分成3类,与品种类型相一致;基于形态性状的聚类结果在一定程度上与此类似。罗玉娣等(2009)应用SSR标记能有效将辣椒野生种和栽培种区分开来,并将相同果型的辣椒种质分为一类。杜晓华等(2006)应用SRAP标记研究辣椒自交系间的遗传差异,结果表明:SRAP标记具有较高的遗传分析效力,基于表型的分析结果与SRAP标记的分析结果相吻合。Finger等(2010)基于RAPD分子标记、形态和农艺性状评价了49个辣椒品种的遗传多样性并将其分为14类,在辣味和地理来源之间没有检测出显著相关关系,认为辣椒果实品质可以通过育种计划改良。可见,利用分子标记评价辣椒资源的遗传多样性是一重要发展趋势。
另外,我国为了维护种质资源的知识产权和品种的真实性,近年来对农作物的DNA指纹图谱鉴定研究越来越来越重视。辣椒品种鉴定的方法包括形态学鉴定、同工酶鉴定、蛋白质鉴定和DNA指纹技术鉴定(李晓辉等, 2003)。采用DNA 指纹技术鉴定品种的真伪与纯度,可克服田间和生化鉴定的缺点,更有利于品种资源、育种材料和杂种的鉴定。近些年,国外已有DNA指纹鉴定的报道。2004年,Jang等开发了两个RAPD标记和两个SCAR标记,用于检测商用杂种Daemyung种子的纯度;经盲测,RAPD和SCAR标记都能检出外来混杂种子。Kwon等(2005)在辣椒品种的DUS (distinctiveness, uniformity,and stability)测试中,评估了SSR标记的品种鉴别潜能,认为SSR标记可用于候选品种的DUS补充检测。但国内尚无有关辣椒指纹图谱构建方面的研究报道。
为此,本研究采用SSR和SRAP这两种简单、高效、成本相对较低的DNA分子标记,对48份辣椒地方种质资源进行遗传多样性和指纹图谱的研究与分析,以期明确辣椒地方资源间的遗传差异,探讨辣椒地方品种亲缘关系与地理来源及果型间的关系,并比较SSR和SRAP的分析结果。同时,构建地方品种的DNA指纹图谱, 并期望提出真实性和纯度鉴定的经济适用的DNA标记。这对于辣椒种质的改良创新和有效利用,以及保护地方品种资源等具有非常重要的意义。
1. 结果与分析
1.1 SSR和SRAP标记位点的多态性检测
从网址(http://www.sgn.cornell.edu/index.pl)上查得75个SSR标记的PCR引物,从(杜晓华, 2006)文献中查得SRAP标记的PCR引物。选用不同果型的遵义朝天椒(ZYCTJ)和J1羊角型椒的DNA样品做模板,用前述引物进行PCR扩增,筛选具有多态性的标记位点。结果有15个SSR位点具有多态性,即:CA514272、 Hpms2-21、BM61910、CB164897、CA525390、 Hpms1-69、 CA516439、 Hpms1-139、 Hpms1-3、Hpms1-155、CA524065、BM64867、 CA525274、Hpms1-43 、CA519548。SRAP标记的30对PCR引物组合中,有11对引物组合的PCR扩增位点具有多态性,这11对引物组合是:me4 +em6、me5 +em6、me3+ em3、me1+ em3、me1+ em6、me5+em7、me2 +em8、me1 +em7、me2 +em7、me5+em8 、me7+em5。每对SRAP的PCR引物组合构成一个SRAP标记。上述具有多态性的SSR和SRAP标记,将用于下述检测分析。
15个SSR标记在48个品种中共检测到41个等位基因(表1),其中38个具有多态性,多态性比率为92.68%,每个标记可检测2~4个等位基因,平均2.7个等位基因。SSR标记的平均多态信息量(PIC)为0.54,变幅为0.44~0.64,以标记Hpms2-21和Hpms1-139最多,CB164897最少。SSR标记的平均标记索引系数(MI)为1.54, 变化范围为1.88~2.56,以标记Hpms1-3最少(图1)。
 表1 48个辣椒地方品种15个SSR标记位点的多态性 Table 1 Polymorphism of 15 SSR markers among the 48 local capsicum varieties |
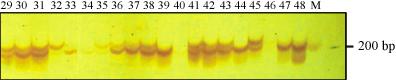 图1 SSR标记Hpms1-3的多态性 Figure 1 Polymorphism for SSR marker Hpms1-3 |
11个SRAP标记在48个辣椒品种中共检测到96个等位基因(表2),其中90个具有多态性,多态性比率为93.75%,每个标记可检测5~17个等位基因,平均16个等位基因,其中以标记“me1 +em7”最多(图2),为17个等位基因。平均多态信息量(PIC)为0.85,变化范围在0.77~0.93之间,以标记“me1 +em7”最多, “me7 +em5”最少。平均标记索引系数(MI)为7.55,变幅为3.85~15.81,以标记“me1 +em7”最多,“me5 +em7”最少。
 表2 48个辣椒地方品种11对SRAP引物组合PCR扩增位点的多态性 Table 2 Polymorphism of loci PCR amplified with 11 pairs of SRAP primers among the 48 local capsicum varieties |
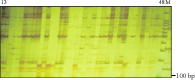 图2 SRAP标记“me1 +em7”的多态性 Figure 2 Polymorphism for SRAP marker “me1 +em7” |
上述结果表明,SSR和SRAP标记位点在辣椒地方品种中存在着丰富的变异,SRAP标记位点的变异比SSR位点的变异更为丰富。
1.2 48个辣椒地方品种的遗传聚类分析
1.2.1 SSR标记的聚类分析
由图3可见,48个品种间的遗传距离值在0.27~0.61之间,其中产自黄平的HPXJ1和产自独山的DSXJ1遗传距离最近为0.27,表明二者的遗传差异较小,亲缘关系较近。
以遗传距离0.578为阈值可将参试品种分为六大类(图3)。
第Ⅰ类只有吉林羊角椒J1。
第Ⅱ类4个品种:FGYTJ13、FGYTJ14、Z042102E、Z0430292;其中按果型含2个圆球型、1个羊角型、1个指型;按原产地含贵州3份(凤岗2份、遵义1份),四川1份。
第Ⅲ类共31个品种,以遗传距离0.547为阈值可将该类分为3个亚类,第1亚类11个品种:Z055027、Z042214、Z042037C、Z042051C、HXDWLJ、Z042035C2、Z042099E、ZYDYZ、Z042089、Z042124A1、Z042154E;其中按果型含3个羊角型、2个牛角型、2个指型、2个锥型、1个线型和1个灯笼型;按原产地含贵州7份(遵义4份、兴义1份、独山1份、花溪1份、剑河1份),省外4份(海南1份、四川1份、广西1份、陕西1份)。第2亚类13个材料Z043019、 Z042001A2、 SYXMJ、 DSXJ、 Z042196E、DFXJ、 Z041035 、HPXJ1、 DSXJ1、 HPXJ 、Z041051、 SYZDT 、JH1;其中按果型含5个型、4个指型、2个锥型、1个羊角型和1个牛角型;按原产地含贵州13份(黄平6份、遵义3份、独山2份、大方1份和剑河1份)。第3亚类7个品种:Z042049C、 Z047044A、Z052224 、Z042008A1、 MTTZJ 、Z042145D2、 Z042005A;其中按果型含2个羊角型、2个指型、1个牛角型、1个圆球型和1个锥型;按原产地含贵州3份(独山1份、黄平1份、遵义1份);省外4份(四川2份、广西2份)。
第Ⅳ类5个品种:Z05210A2、Z042180E、Z052212C、ZYCTJ、XZCTJ;其中按果型含2个锥型、1个线型、1个指型和1个羊角型;按原产地含贵州5份(遵义3份、兴义1份、独山1份)。
第Ⅴ类4个品种:Z042137D、Z042004A2、SYTZJ、Z052204;其中按果型含2个指型、1个羊角型和1个圆球型;按原产地含贵州4份(黄平2份、遵义1份、兴义1份)。
第Ⅵ类3个品种:Z047068B、Z042191D 、Z042110D;其中按果型含2个指型、1个牛角型;按原产地含贵州2份(黄平1份、兴义1份),四川1份。
.png) 图3 48个辣椒品种15个SSR标记的聚类图 Figure 3 The dendrogram of the 48 local capsicum varieties based on the 15 SSR markers |
1.2.2 SRAP标记的聚类分析
由图4可见,48个品种间的遗传距离值在0.39~0.669之间,以遗传距离0.598为阈值可将上述辣椒品种分为七类。
第Ⅰ类2个品种:SYXMJ和 DSXJ;按果型含1个指型、1个线型;按原产地含贵州黄平和独山各1份。
第Ⅱ类3个品种: Z052224、 Z042089、Z047068B;按果型含2个指型和1个羊角型;按原产地含贵州遵义1份、广西2份。
第Ⅲ类20个品种:FGYTJ14 、ZYDYZ 、Z042124A1、 Z042180E、 Z043019、 HPXJ1 、DSXJ1、 ZYCTJ 、XZCTJ、 HPXJ 、DFXJ、 Z042154E、 Z042110D 、Z0430292 、Z042102E、 Z052204、 Z042137D、 Z041051、 FGYTJ13和 JH1;按果型含6个指型、6个线型、2个羊角型、2个圆球型和4个锥型。按原产地含贵州19份(黄平5份、遵义5份、兴义2份、独山3份、剑河1份、大方1份、凤岗2份),四川1份。
第Ⅳ类10个品种:Z042191D 、Z042001A2、 Z052212C 、Z055027 、Z041035 、J1、 Z042099E 、Z042037C 、Z047044A 、Z042008A1,按果型含羊角型3份、牛角型2份、指型2份、锥型2份、灯笼型1份,按原产地含贵州4份(遵义3份、黄平1份),省外6份(四川2份、海南1份、广西1份、陕西1份、吉林1份)。
第Ⅴ类2个品种:Z042004A2 、Z042051C,按果型含羊角型1份和牛角型1份,按原产地含贵州遵义1份、广西1份。
第Ⅵ类10个品种:Z042005A、 Z042196E、 Z042035C2 、Z05210A2、 Z042145D2 、Z042049C、 MTTZJ、 SYZDT、 SYTZJ 、HXDWLJ;按果型含4份羊角型、2份指型、2份圆球型、1份牛角型和1份锥型;按原产地含贵州9份(遵义3份、黄平3份、花溪1份、独山1份、兴义1份),四川1份。
第Ⅶ类只有 贵州兴义指型椒Z042214一个品种。
 图4 48个辣椒品种11对SRAP引物PCR扩增位点的聚类图 Figure 4 The dendrogram of the 48 local capsicum varieties based on the loci PCR amplified with 11 pairs of SRAP primers |
1.2.3 SSR和SRAP标记组合的聚类分析
由图5可见,48个辣椒品种间的遗传距离在0.434~0.629之间,以遗传距离0.598为阈值,可将上述辣椒品种分为5大类:
第Ⅰ类只有 贵州兴义指型椒Z042214一个品种。
第Ⅱ类12个品种:Z042051C、 Z042004A2、 Z05210A2 、Z042035C2 、Z042196E、 Z042049C 、Z042145D2、 Z042005A、 MTTZJ 、SYTZJ、 SYZDT 、HXDWLJ;按果型含羊角型5份、牛角型2份、圆球型2份、指型2份、锥型1份;按原产地含贵州10份(遵义4份、黄平3份、独山1份、花溪1份、兴义1份),省外2份(四川1份、广西1份)。
第Ⅲ类7个品种:DSXJ、 SYXMJ、ZYCTJ、 XZCTJ、 Z047068B、 Z042089、 Z052224; 按果型含指型3份、锥型2份、牛角型1份、线型1份;按原产地含贵州5份(遵义3份、黄平1份、独山1份),广西2份。
第Ⅳ类10个品种:Z042008A1、 Z047044A、 Z042099E 、Z042037C 、Z042191D、 Z042001A2 、Z052212C、 Z055027 、Z041035、 J1;按果型含羊角型3份、牛角型2份、锥型2份、灯笼型1份、指型2份;按原产地含贵州4份(遵义3份、黄平1份),省外6份(四川2份、海南1份、广西1份、吉林1份、陕西1份)。
第Ⅴ类18个品种: FGYTJ14 、ZYDYZ、 Z042124A1 、Z042180E、 DSXJ1、 HPXJ1 、Z042137D 、Z052204、 Z042102E 、FGYTJ13 、Z0430292 、Z042110D 、Z042154E 、DFXJ、 HPXJ 、Z043019 、Z041051、 JH1;按果型含线型6份、指型6份、圆球型2份、锥型2份、羊角型2份;按原产地含贵州17份(黄平5份、遵义3份、独山3份、凤岗2份,兴义2份、剑河1份、大方1份),四川1份。
 图5 48个辣椒品种15个SSR标记位点和11对SRAP引物PCR扩增位点的聚类图 Figure 5 The dendrogram of the 48 local capsicum varieties based on the 15 SSR markers and loci PCR amplified with 11 pairs of SRAP primers |
1.2.4 聚类结果的比较分析
总体看来,SSR和SRAP标记的聚类结果大致相同,可把大部分品种聚在一起;SRAP和SSR+SRAP标记的聚类结果更为相近。但是,SSR聚类把线型椒和指型椒、羊角型椒和牛角型椒聚为一大类,而SRAP和SSR+SRAP却将绝大多数线型椒和指型椒聚为一类、羊角型椒和牛角型椒聚为一类。这与SSR和SRAP标记检测的位点及其数量有关。
从辣椒果型聚类分析结果可以看出:锥型椒和圆球型椒分布在各类群中,表明它们的遗传差异比较复杂,与果型没有密切关系;灯笼型椒和羊角型椒、牛角型椒可聚为一类,表明它们之间的遗传差异较小,亲缘关系较近;大部分线型椒和指型椒聚为一类,羊角型椒和牛角型椒聚为一类,表明其两两之间具有较近的亲缘关系。
从地理来源聚类分析结果可以看出,SSR、SRAP和SSR+SRAP都能较好的把大多数来自省外的品种聚为一类,如SRAP和SSR+SRAP聚类的第Ⅳ类中,10个品种有6个来自外省;SSR聚类的第Ⅲ类第1亚类和第3亚类中都有4个品种来自外省,可见,SSR、SRAP和SSR+SRAP的分子分类与地理来源之间有一定的关联。
1.3 48个辣椒地方品种的DNA指纹图谱分析
1.3.1 SSR标记和SRAP标记的数字化指纹图谱
将48个辣椒地方品种的SSR和SRAP标记电泳图谱同一位置上谱带的无带和有带转化成由0、1组成的数字图谱,各品种分别可由一串不同的数字号码代表,从而建成参试品种的数字化指纹图谱(表3, 表4)。根据遗传学和概率论原理,出现与15个SSR标记指纹完全相同的概率为1.135×10-13,与11对SRAP引物PCR扩增位点指纹完全相同的概率为1.26×10-29。可见,无论是SSR标记指纹图谱还是SRAP标记指纹图谱,均可用于鉴别上述48个品种,尤以SRAP标记指纹的鉴别效果为优。
 表3 48个辣椒地方种的SSR数字化指纹 Table 3 SSR fingerprint data of 48 local capsicum varieties |
试剂:dNTP、MgCl2、Taq酶均购自立陶宛MBI公司;丙烯酰胺,尿素,Tris购自上海生工;其它试剂均为国产试剂。SSR引物,SRAP引物均由北京三博远志生物有限公司合成。
 表4 48个辣椒地方种的SRAP数字化指纹 Table 4 SRAPfingerprint data of 48 local capsicum varieties |
1.3.1 SSR标记和SRAP标记的鉴别能力分析
用每个标记的指纹数据分别作聚类分析,设定品种间遗传距离大于零者,为该标记可鉴别的品种,则:单个SSR标记,均不能独立鉴别48个参试品种,鉴别品种数分别在5~24个之间,以标记Hpms2-21鉴别份数最多,标记CB164897鉴别份数最少。只有将标记CA514272、Hpms2-21、 Hpms1-69、 CA516439、 Hpms1-139、 BM61910组合起来,才能完全鉴别48个参试品种。这说明在本研究中,要鉴别48个参试品种,最少需要6个SSR标记。
同样,一对SRAP引物PCR扩增位点标记不能独立鉴别48个参试品种,SRAP标记me1+em3、me3+em3和me5+em6的PCR扩增位点标记分别能鉴别3个材料,标记me1+em6的能鉴别8个材料,标记me5+em7和me7+em5的分别能鉴别12个材料,标记Me2+em8的能鉴别16个材料,标记me4+em6的能鉴别17个材料,标记me2+em7的能鉴别24个材料,标记me5+em8的能鉴别33个材料,标记me1 +em7的能鉴别42个材料。利用独立鉴别能力强的标记me1 +em7分别与其他10 对进行两两组合,只有标记“me1+em7”+“me1+em3”、“me1 +em7”+“me3+em3”、“me1 +em7”+“me5+em6”、“me1 +em7”+“me5+em8”或“me1 +em7”+“me2+em8”才能分别鉴别全部参试品种。这说明在本研究中,要鉴别48个参试品种,最少需要2对SRAP标记。设定品种间最小遗传距离大者为优选组合,则:上述标记中,以“me1 +em7”+“me2+em8”的最小遗传距离为大(0.28),因此该标记是鉴别48个参试品种的最优标记。
2讨论
在供试材料聚类分析结果中,48份地方品种间最小遗传距离为0.27,最大遗传距离为0.669,品种间的遗传差异明显,遗传多样性丰富。无论是SSR、SRAP、还是SSR+SRAP的分子标记聚类,都是先从线椒开始,表明线椒品种间的遗传差异较小,亲缘关系较近。可能与线椒(var.logum)和圆锥型椒(var.conoides)是较为原始的2A核型,辣椒的进化较早有关(李光涛等, 1992; 李光涛等, 1993)。部分线椒和指型椒品种、牛角椒和羊角椒品种聚为一类,表明线型椒和指型椒、牛角椒和羊角椒之间也有较近的亲缘关系。锥型椒则分布在各类群中,表明锥型椒的遗传差异比较复杂,这可能与锥型椒是辣椒栽培种中进化较早的品种有关(陈学军等, 2009; 李光涛等, 1992; 李光涛等, 1993)。总体来说,SSR、SRAP和SSR+SRAP聚类基本上可把相同果型的品种聚为一类。周晶等(2009)采用109对SSR特异引物对89份辣椒材料进行分析,89份材料在遗传相似系数0.6处分为两类,可以将栽培种和野生种区分开来,将果实类型相似的种质基本都聚在一起。罗玉娣等(2009)利用21对SSR引物在3 3个辣椒材料中共检测到5 4个等位基因 ,把33个辣椒材料分为五类,同个种的辣椒种质资源基本聚在一起。这表明分子标记分类结果与形态学分类基本一致但是,本研究中省内同一原产地的品种却大都未被分在同一类中,而省外品种则基本上可聚在一起,表明分子标记的分类结果与省内品种的地理来源没有什么相关性。可见,在辣椒的遗传改良和育种中,应主要考虑遗传差异和果型差异,其次才考虑品种的地理来源,且主要考虑省内和省外来源品种。
在辣椒种质资源遗传多样性评价方面,大多是利用单个分子标记进行分析评价的(罗玉娣等, 2006; 周晶等, 2009; 张素琴等, 2009)。本研究,利用了SSR标记、SRAP标记以及SSR+SRAP标记在48个品种中的检测数据进行聚类分析,评估品种的遗传差异,并进行比较分析。另外,本研究在48个辣椒地方品种中,15个SSR标记平均可检测多态性等位基因2.7个,11个SRAP标记平均可检测多态性等位基因16个,SRAP标记平均检测等位数是SSR的5倍,表明SRAP标记较SSR标记有较高的多态性检测能力。这与杜晓华等(2007)的研究结论一致。我们认为,基于SSR+SRAP标记的遗传多样性评价,由于检测的遗传位点较多,其遗传评估比较切合实际。如SSR+SRAP第Ⅳ类把大多数省外品种分在一起, 10个品种中6个来自省外,占参试省外品种的60%;第Ⅴ类主要是线椒和指型椒,分别占同类参试材料的85.7%和42.8%。
在DNA指纹图谱构建方面,本研究不仅构建了48个辣椒品种的SSR和SRAP标记的指纹图谱,为这些品种的真实性和纯度鉴定提供依据。而且采用聚类分析方法,假定品种间某(些)分子标记遗传距离大于零者为某(些)分子标记可鉴别的品种,分析DNA分子标记鉴别品种的能力;并且,又假定以品种间某(些)分子标记最小遗传距离大者为优,筛选出鉴定参试品种所需的最小标记数。据此,参试的8个品种,只需选择CA514272、Hpms2-21、 Hpms1-69、 CA516439、 Hpms1-139和 BM61910等6个SSR标记或“me1+em7”和“me2+em8”两个SRAP标记即可鉴定。该方法直观、易行、快速、高效,采用最少标记数即可达到理想的鉴别效果,可为筛选DNA指纹图谱中经济有效的分子标记提供技术支撑。
3材料与方法
3.1 试验材料
辣椒材料:参试48份辣椒地方品种种子由贵州省辣椒研究所收集、冷藏保存和田间种植保存。这些品种按原产地划分,包含四川4份,广西4份,陕西1份,海南1份,吉林1份,贵州37份(其中遵义13份, 黄平10份, 独山5份, 兴义4份, 凤岗2份, 花溪1份, 剑河1份, 大方1份);按果型划分,指型14份,羊角型10份,线型7份,锥型7份,牛角型5份,圆球型4份,灯笼型1份(表5)。
 表5 供试材料名称、果型及原产地 Table 5 The name, fruit shape and origin of experimental materials |
3.2试验方法
3.2.1辣椒基因组DNA提取
在辣椒生长旺期取植株顶端幼嫩叶片5~10g提取基因组DNA,采用杨文鹏(2005)改进的CTAB方法。所提DNA样品用核酸蛋白分析仪(GeneQuant 1300,产地瑞典)检测浓度,并稀释到50 ηg/ul,于4℃保存备用。
3.2.2 SSR标记反应体系及PCR扩增程序
SSR-PCR反应体系为:在25 uL的总体积中,40 ηg的模版DNA,2.5mmol/L的Mg2+、 0.2 mmol/L的dNTP、1U的Taq酶、2条引物均为0.1 μmol/L。扩增按照Lee等(2001)的方法进行。
3.2.3 SRAP标记反应体系及PCR扩增程序
SRAP-PCR反应体系采用何建文等(2009)的优化体系,在25 μL体系中含60 ηg的模板DNA 、1.5 mmol/L的Mg2+、 0.2 mmol/L的dNTP、1 U的Taq酶和0.1 μmol/L的单条引物。扩增程序为:94℃预变性5 min;94℃变性1 min,35℃复性1 min,72℃ 延伸1 min,5个循环;94℃变性1 min,50℃复性1 min,72℃延伸1 min,35个循环;最后72℃延伸10 min,4℃保存。
3.2.4 电泳分析检测
SSR和SRAP的PCR扩增产物均用6% 的变性聚丙烯酰胺凝胶电泳(70 W 恒功率)分离,1500 V电泳85 min左右,固定、银染、显影、定影等参照许绍斌等(2002)的方法进行。
3.2.5 数据统计分析
将电泳图谱上同一位置清晰出现的条带记为“1”,没有条带记为“0”,缺失的记为“.”由此生成“0”、“1” 和“.”原始矩阵。统计每对引物扩增出的总条带数和多态性条带数。每个SSR位点的多态性信息量(Polymorphic Information Content,简称PIC)按Senior M S等提供的公式计算,即PIC=1-∑fi2,其中fi为i位点的基因频率;标记索引系数(Marker index,简称MI)按Smith提供的公式MI=Allele×PIC计算,Allele为扩增位点的等位基因数。用SYSTAT10.2软件进行数据分析,按类平均距离法,以欧氏距离进行聚类分析。
作者贡献
何建文是本研究的实验设计和试验研究的执行、数据分析、论文初稿的写作人,姜虹和韩世玉是试验所需材料的提供人,杨红是田间果型性状调查与数据整理人;杨文鹏是项目的构思者及负责人,指导试验设计、论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由贵州省“十一五”科技攻关项目(黔科合NZ字(2005)3010)资助。作者感谢贵州省旱粮研究所王伟在本实验过程中的技术支持和有益的建议。
参考文献
Chen X.J., Fang R., and Zhou K.H., 2009, The variety sibship of quantitative classify research in Hot Pepper (Capsicum annum L.), Xiandai Yuanyi(Jioral of modernity horticulture), 8: 23-27 (陈学军, 方荣, 周坤华, 2009, 辣椒种质亲缘关系的数量分类学研究, 现代园艺, 8: 23-27)
Du X.H., Gong Z.H., Wang D.Y., and Yin Q.M., 2006 Genetic Differences among Well—performing Inbred Lines of Hot Pepper (Capsicumannuum L.), Xibei Zhiwu Xuebao (Jioral of Acta Bot. Borea1-Ocident, Sin), 2006, 26(12): 2445-2452(杜晓华, 巩振辉, 王得元, 殷秋妙, 2006, 辣椒优良自交系间遗传差异的分子分析, 西北植物学报, 26(12): 2445-2452)
Du X.H., Wang D.Y., and Gong Z.H., 2007, Estimation and comparison of genetic distances among el ite inbred lines in hot pepper (Capsicum annuum L.) by RSAP and SSR, Xibei Nonglin Keji Daxue Xuebao (Journal of Northwest A & F. Universi), 35(7): 97-103 (杜晓华, 王得元, 巩振辉, 基于RSAP和SSR的辣椒优良自交系间遗传距离的估计与比较, 西北农林科技大学学报, 35(7): 97-103)
Finger F.L., Lannes S.D., Schuelter A.R., Doege J., Comerlato A.P., Goncalves L.S.A., Ferreira F.R.A., Clovis L.R., and Scapim C.A., 2010, Genetic diversity of Capsicum chinensis (Solanaceae) accessions based on molecular markers and morphological and agronomic traits, Genetics and Molecular Research 9(3): 1852-1864
doi:10.4238/vol9-3gmr891 PMid:20882481
He J.W., Yang W.P., Han S.Y., and Yang H., 2009, Single major influencing factor and It’S Orthogonal Optimized Design of SRAP—PCR in Hot Pepper (Capsicum annum L.), Zhongzi (Jioral of Seed), 9(28): 24-30 (何建文, 杨文鹏, 韩世玉, 杨红, 2009, 辣椒SRAP—PCR反应体系主要影响因素的单因素和正交设计优化, 种子, 9(28): 24-30)
Jin M.Y., Liu L.Z., Fu F.Y., Zhang Z.S., Zhang X.K., and Li J.N., 2006, Construction of a genetic linkage map in brassica napus based on SRAP, SSR, AFLP and TRAP, Fenzi Zhiwu Yuzhong (Journal of Molecular Plant Breeding), 4(4): 520-526 (金梦阳, 刘列钊, 付福友, 张正圣, 张学昆, 李加纳, 2006, 甘蓝型油菜SRAP、SSR、AFLP和TRAP标记遗传图谱构建, 分子植物育种, 4(4): 520-526)
Lee J.M., Nahm S.H., Kim Y.M., and Kim B.D., 2004, Characterization and molecular genetic mappingof microsatelliite loci in pepper, Theor. Appl. Genet., 108: 619-627
Li X.H., Li X.H., and Zhang S.H., 2003, New plant variety protection and DUS testing technique system, Zhongguo Nongye Kexue (Journal of Scientia Agtlcultura Sinica), 36(11): 1419-1422 (李晓辉, 李新海, 张世煌, 2003, 植物新品种保护与DUS测试技术, 中国农业科学, 2003, 36(11): l4l9-l422)
Luo Y.D., Li J.G., and Li M.F., 2006, Analysis of genetic diversity of capsicumgermplasm resources by using SSR Markers, Shengwu Jishu Tongbao (Cbiotechnology bulletin), 336-341 (罗玉娣, 李建国, 李明芳, 2009, 用SSR标记分析辣椒属种质资源的遗传多样性, 生物技术通报, 336-341)
Li G.T., and Liang T., 1993, Karyotype studies on 4 taxa of capsicum, Guangxi Zhiwu (Journal of guangxi beeeding plant), 13(2): 155-158 (李光涛, 粱涛, 1993, 4种(变种)辣椒的核型研究II, 广西植物, 13(2): 155-158)
Li G.T., and Liang T., 1992, Karyotype studies on 2 taxa of capsicum, Xinan Nongye Daxue Xuebao (Journal of Southwest Agricultural Universit), 14(1): 82-85 (李光涛, 粱涛, 两种辣椒的核型研究II, 西南农业大学学报, 14(1): 82-85)
Li S.X., 1986, Vegetable cultivation, Beijing, China Agricultural Press, pp.227-230(李曙轩, 1986, 蔬菜栽培学各论, 北京: 中国农业出版社, pp.227-230)
Inok J., Ji H.M., and Jae B.Y., 2004, Application of RAPD and SCAR Markers for Purity Testing of F1 Hybrid Seed in Chili Pepper (Capsicum annuum), Molecules and Cells, 18(3): 295-299
Pickersgill B., 1997, Genetic resources and breeding of Capsicum spp., Euphytica, 96: 129-133 doi:10.1023/A:1002913228101
Wen Y.C., Wang H.Z., Shen J.X., and Liu G.H., 2006, Comparision of cultivar fingerprints constructed with SRAP and SSR markers in Brassica napus L., Zhongguo Youliao Zuowu Xuebao (Chinese jotlrnal of oil crop science), 28(3): 233-239(文雁成, 王汉中, 沈金雄, 刘贵华, 2006, SRAP和SSR标记构建的甘蓝型油菜品种指纹图谱比较, 中国油料作物学报, 28(3): 233—239)
Xu S.B., Tao Y.F., Yang Z.Q., and Chu J.Y., 2002, A Sim ple and Rapid Methods Used for Silver Staining and Gel Preservation, Yichuan (Jioral of heredita, 4(3): 335-336) (许绍斌, 陶玉芬, 杨昭庆, 褚嘉祜, 2002, 简单快速的DNA银染和胶保存方法, 遗传, 4(3): 335-336)
Yong S.K., Je M.L., and Gi B.Y., 2005, Use of SSR Markers to Complement Tests of Distinctiveness, Uniformity, and Stability (DUS) of Pepper (Capsicum annuum L.) Varieties., Molecules and Cells, 19(3): 428-535
Yang W.P., 2004, Molecular Mapping of a High-lysine Mutant Gene and Analyses of Heterofertilization of o2 Endosperm and Allelic Variation at o2 Locus in Maize, Jioral of huazhong agricultural university doctoral dissertation, pp.43-44(杨文鹏, 2004, 玉米一个高赖氨酸突变基因的定位及o2胚乳异雄核受精和o2位点等位变异的分析, 华中农业大学, 博士论文, 导师: 郑用琏, pp.43-44)
Zhang Y., Guo S.W., He B., and Gao D.Y., 2006, Construction of M olecular Fingerprinting Database for Hybrid Rice Using SSR Markers, Jiangsu Nongye Xuebao(Journal of Jiangsu Agtlcultura Sinica), 22(2): 181-183 (张彦, 郭士伟, 何冰, 高东迎, 2006, 利用SSR标记建立杂交水稻分子指纹图谱数据库, 江苏农业学报, 22(2): 181-183)
Zhao L.P., Liu L.W., Gong Y.Q., Wang M.X., Yu F.M., and Wang L.Z., 2007, Cultivar fingerprinting in radish (Raphanus sativus) with SRAP and AFLP marker, Zhiwu Yanjiu (Journal of bulletin botanical research), 11(6): 687-695 (赵丽萍, 柳李旺, 龚义勤, 王明霞, 郁樊敏, 汪隆植, 2007, 萝卜品种指纹图谱SRAP与AFLP分析, 植物研究, 11(6): 687-695)
Zhou J., Shen H.L., Yang W.C., Tan F., Wang Y.L., and Guo S., 2009, Analysis of Genetic Diversity of Capsicum Germplasm by Using SSR M arkers, Huabei Nongxuebao (Journal of huabei Agricultural Sinica), 24: 62-67 (周晶, 沈火林, 杨文才, 谭芳, 王银磊, 郭爽, 2009, 辣椒遗传多样性的SSR分析, 华北农学报, 24: 62-67)
Zhang S.Q., Gen G.D., Zhou X.T., and Yang T., 2008, Analysis of morphologies and SRAP markers of pepper germplasm resources in Guizhou, Shandi Nongye Shengwu Xuebao (Journal of Mountain Agriculture& Biology), 246: 228-232(张素勤, 耿广东,周贤婷, 杨继涛, 2008, 贵州辣椒种质资源的表型和SRAP分析, 山地农业生物学报, 246: 228-232)